
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
|
|
В отличие от уплотненной глины в неуплотненной глине поры имеют значительные размеры, в которые способны вместе с водой проникать как гидратированные ионы, так и макромолекулы полимеров. В зависимости от вида электролитов результаты взаимодействия проникших в поры глины ионов могут быть различными. Как отмечено выше, все электролиты можно разделить на три группы: щелочные, кислотные и нейтральные.
При взаимодействии щелочных электролитов (невысокой концентрации) с глинистыми частицами происходит активация последних (смотри часть 1,
п 4.3)
SiOH+NaOH  ® SiO- +H2O+Na+,
® SiO- +H2O+Na+,
в результате чего объемная энергия глины возрастает, увеличивается «всасывание» воды, повышается влажность, понижается пластическая прочность глины.
С увеличением концентрации щелочи количество катионов в растворе возрастает, увеличивается плотность эффузивного слоя и при
 некоторой критической концентрации электролита происходит постепенная де зактивация глинистых частиц, в результате чего толщина гидратного слоя воды вокруг частиц понижается, понижается влажность глины, повышается ее пластическая прочность глины.
некоторой критической концентрации электролита происходит постепенная де зактивация глинистых частиц, в результате чего толщина гидратного слоя воды вокруг частиц понижается, понижается влажность глины, повышается ее пластическая прочность глины.
Степень гидратации и дегидратации для различных щелочных электролитов при повышении их концентрации различна. Она зависит от гидрофильности катионов, силы взаимодействия их с анионами раствора и растворимости электролитов.
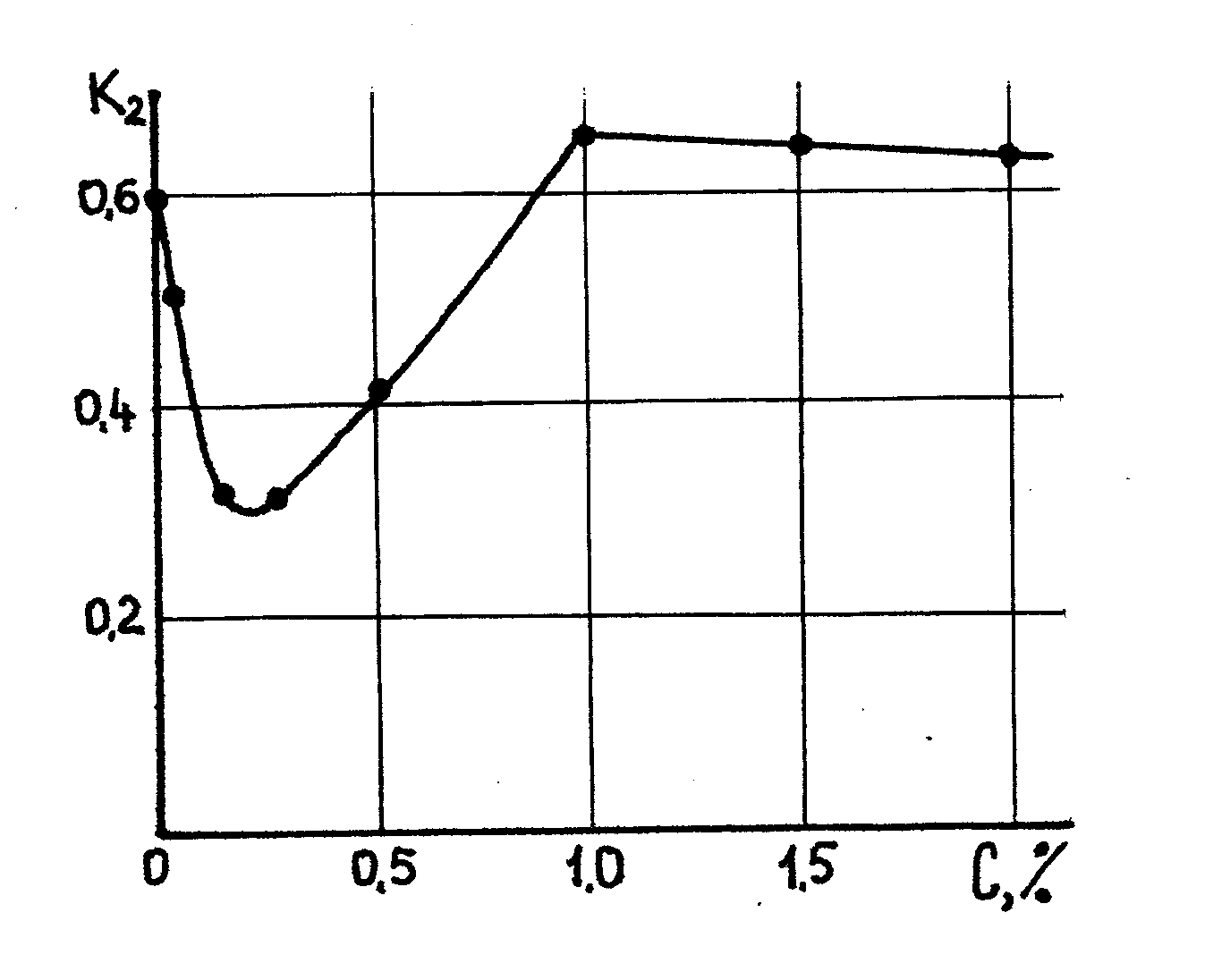
Рис. 10. 1. Зависимость влажности глинистых образцов К2 помещенных в раствор щелочных электролитов от концентрации последних: 1- в раствор NaOH, 2 - в раствор Na2SiО3, 3- раствор Na2СО3, 4 - в раствор Na3РO4. 5 - раствор Ва (ОН)
На рис. 10.1. показан график зависимости гидратации и дегидратации образцов неуплотненной глины, помещенных в растворы различных щелочных электролитов (этот и последующие графики построены по экспериментальным материалам В.Д. Городнова)
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Исследования показывают, что наиболее активно гидратация протекает при введении в раствор щелочей NaOH, КОН, Ва(ОН)2, менее активно (вследствие меньшей концентрации гидроксильных групп в растворе) для щелочных солей и совсем неактивно для слаборастворимых оснований Са(ОН)2.
Активность дегидратации зависит от плотности и активности катионов в диффузном слое вокруг глинистых частиц, концентрации и активности анионов электролитов. В растворах щелочных солей при гидролизе образуется значительное количество достаточно активных анионов НРО42-, Н2РО4-, НСО3- и т.д., снижающих активность катионов.
В растворах хорошо растворимых щелочей (например, растворах NaOH с растворимостью 108 г. на 100мл. воды) после гидратации частиц концентрация катионов быстро возрастает, дегидратация глинистых частиц протекает интенсивно.
В растворах менее растворимых щелочей Ba(OH)2 (с растворимостью 39 грамм на 100 мл. воды), количество катионов в растворе значительно меньше. Да и катионы более гидрофильны и менее подвижны. Поэтому, несмотря на большую валентность катионов, нейтрализация глинистых частиц происходит слабее, область дегидратации значительно растягивается.
При взаимодействии нещелочных электролитов с глинистыми частицами гидратация частиц не возможна, даже при малой концентрации электролита в результате нейтрализации потенциала глинистых частиц наблюдается их дегидратация.
Активность взаимодействия катионов с глинистыми частицами в соответствии с исследованиями К.К. Гедройца (см. часть 1, п. 4.4.) зависит от их валентности и ионного радиуса. Для почв, грунтов (в том числе и глинистых) вследствие малого ионного радиуса наибольшую активность проявляет ион водорода Н+, а наиболее сильным нещелочным электролитом являются кислоты, активно нейтрализующие потенциал частиц, интенсивно понижающие влажность глины.
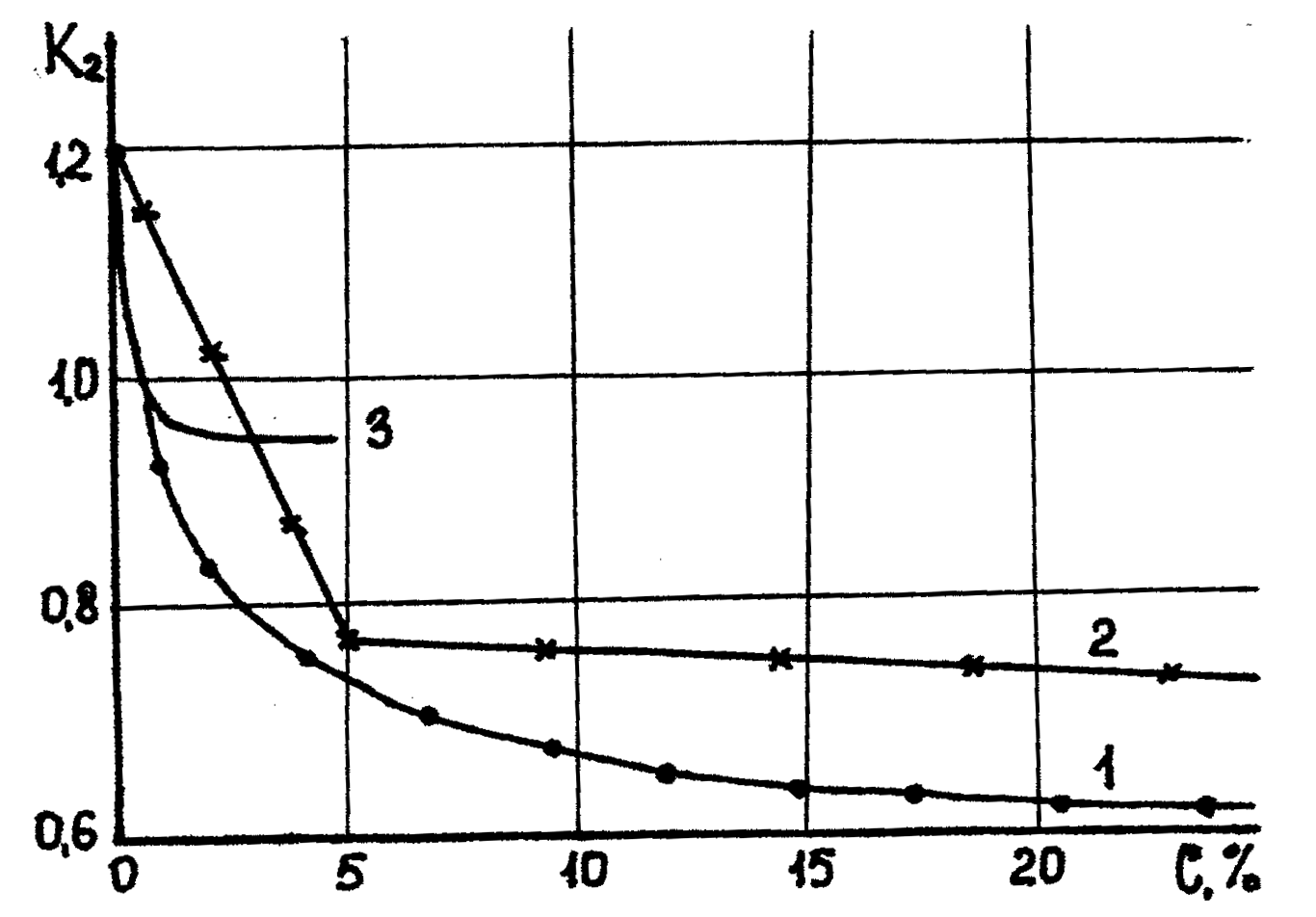
Как показывают экспериментальные исследования В.Д. Городнова с помощью кислот можно понизить влажность глины К2 до 0, 3, чего вследствие гидрофильности других катионов достичь невозможно. На рис.10.2. показана зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации. В противоположность действию на глинистые частицы щелочных электролитов вместо гидратации мы наблюдаем дегидратацию частиц.
Такую зависимость можно объяснить следующим образом. За счет нейтрализации заряда глинистых частиц при концентрации кислоты до 0, 3% влажность глины К2 понижается (до 30%), а при дальнейшем повышении концентрации в растворе появляется избыток анионов Cl+ (так как часть катионов адсорбируется глинистыми частицами), который образует
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
 второй слой ДЭС глинистых частиц. Происходит их постепенная активация и гидратация до нормальной влажности глины.
второй слой ДЭС глинистых частиц. Происходит их постепенная активация и гидратация до нормальной влажности глины.
Рис. 10.2. Зависимость влажности глинистых образцов в растворе соляной кислоты от ее концентрации
 Растворы нейтральных электролитов при малых концентрациях не вызывают экстремальных значений повышения или понижения влажности глины. Начиная с нулевой концентрации, они с увеличением концентрации, плавно понижают влажность глины до некоторого предела характерного для данного раствора. Вследствие гидрофильности катионов понизить влажность глины до нуля невозможно.
Растворы нейтральных электролитов при малых концентрациях не вызывают экстремальных значений повышения или понижения влажности глины. Начиная с нулевой концентрации, они с увеличением концентрации, плавно понижают влажность глины до некоторого предела характерного для данного раствора. Вследствие гидрофильности катионов понизить влажность глины до нуля невозможно.
Рис. 10.3. Зависимость влажности глинистых образцов в растворе электролитов солей одновалентных металлов от концентрации последних: 1 – CaCl2; 2 – СaSO4; 3 – BaCl2; 4 - KАlSO4
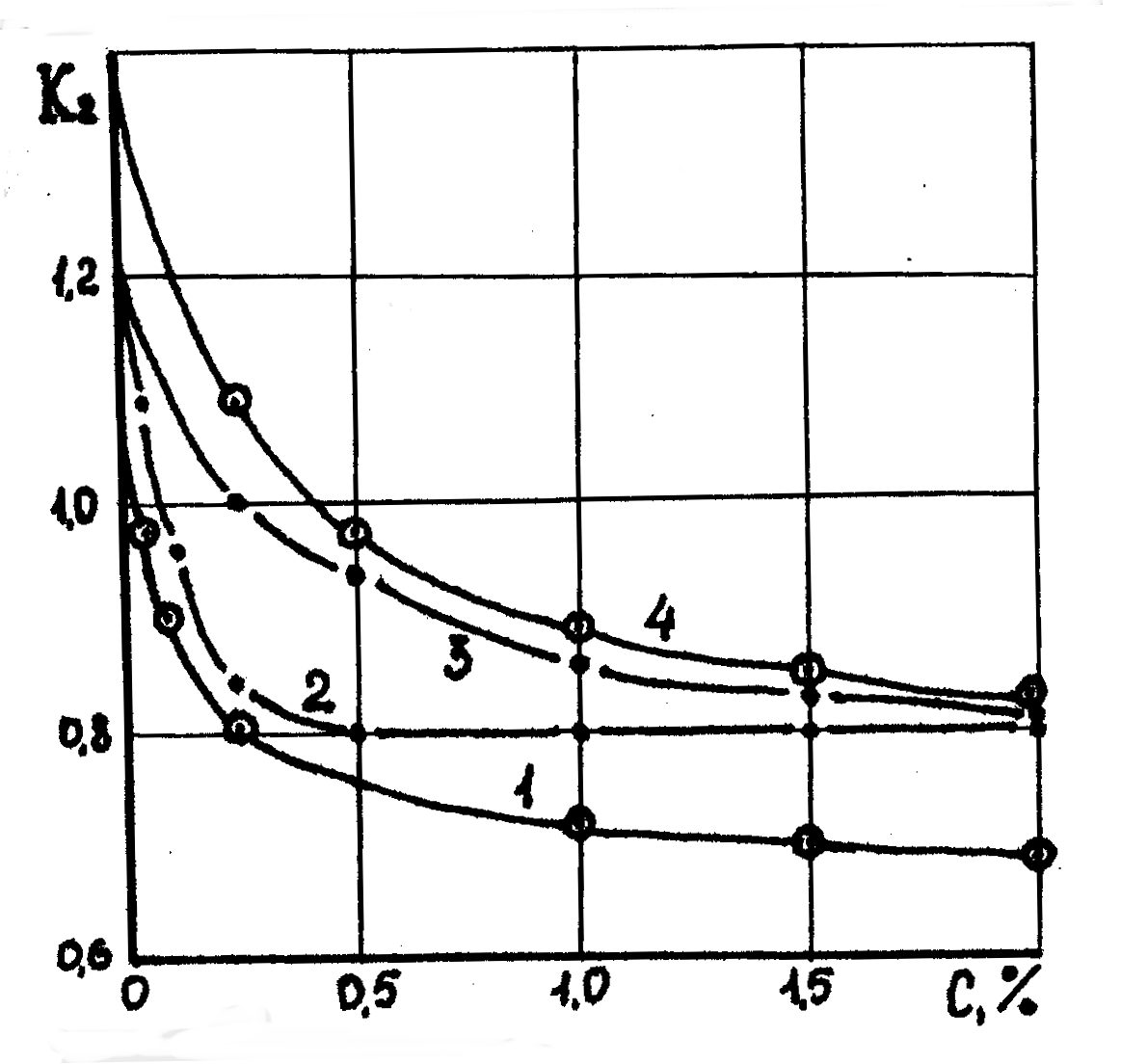 Из рис.10.3 и 10.4 видно что влажности, зависит от гидрофильности катионов и анионов с увеличением гидрофильности. Эффективность электролита понижается, а с увеличением валентности катионов резко повышатеся.
Из рис.10.3 и 10.4 видно что влажности, зависит от гидрофильности катионов и анионов с увеличением гидрофильности. Эффективность электролита понижается, а с увеличением валентности катионов резко повышатеся.
Рис. 10.4. Зависимость влажности глинистых образцов в растворе нещелочных электролитовполивалентных металлов от концентрации последних: 1-CaCl2; 2-СаSО4; 3-ВаСl2; 4-КАlЅО4
То же самое можно наблюдать и для электролитов с поливалентными катионами (рис.10.4).
Из рисунка 10.3 и 10.4 также следует, что при малой концетрации электролита интенсивность понижения влажности многократно выше, им при последующим повышений концетрации это можно объяснить следующим образом.
При введении раствора электролита в суспензию свежего бентонита с гидрофильной дисперсной фазы катионы активно взаимойдействует с глинистыми частицами нейтрализует их заряд, а следовательно понижают влажность образца. После установления равновесия содержания катионов в глине и растворе снижаетя до нуля. С повышением концетрации электролиа в растворе вновь появления добаланс катионов и анионов. Из раствора вновь поступаю в суцементированые влажность еще больше понижается. Но количество катионов взаимодействует с глинистыми частицами будет меньше, так как глины уже частично нейтрализованы. Поэтому темп снижения влажности снижается. Такой процесс приводит к равновесию раствора и глины и т.д.
При бурении скважины постоянно обнажаются стенки скважины и также процесса будут многократно повторяться. И при постоянной концетрации электролитов равновесие будет наблюдаться на все меньшим уровне. Эффективность раствора снижения водоотдачи будет все время снижаться с целью определения оптимальной концетрации раствора при бурении необходимо постоянно отбирать пробы раствора определять концетрацию электролиты и в случае необходимости повышать концетрации.
Прочность глинистых пород находится в прямой зависимости от их влажности. Глинистые частицы, как отмечено, связаны между собой пленками воды. Прочность же пленок зависит от энергии межмолекулярного взаимодействия (U) каждой молекулы воды с глинистыми частицами.
Глинистые частицы породы находятся на относительно небольшом расстоянии друг от друга, и каждая молекула воды взаимодействует одновременно не с одной (как в буровом растворе), а с целым рядом близлежащих глинистых частиц. Энергию взаимодействия молекул воды с этими частицами можно определить суммированием энергий взаимодействий молекулы воды с каждой частицей в отдельности, например, с помощью интегрирования.
Приближенный расчет в предположении аддитивности (суммирования) энергии межмолекулярных взаимодействий как отмечено выше был проведен Буром и Гамакером [6, 9].
Для вывода уравнения энергии межмолекулярного притяжения использовалось уравнение энергии притяжения одной молекулы к поверхности адсорбента (в данном случае глинистых частиц):
 (10.1)
(10.1)
где С - константа, зависящая от природы взаимодействующих молекул, n - число частиц; h - расстояние от молекулы воды до глинистых частиц (толщина пленки воды).
В результате после интегрирования Бур и Гамакер получили формулу
 , (10.2)
, (10.2)
где А-константа Гамакера, равная примерно 10-19 Дж.
Удельная сила взаимодействия молекул воды с поверхностью глинистых частиц (прочность пленки) соответственно будет равной
 , (10.3)
, (10.3)
где Со - постоянная величина.
С увеличением влажности глины толщина пленки увеличивается, а ее прочность и прочность глины в целом понижаются
Влажность глины можно выразить формулой
 , (10.4)
, (10.4)
где Vв - количество воды, поглощенной глиной; S - суммарная поверхность глинистых частиц, m – количество частиц, h – толщина пленки воды. Отсюда
 , (10.5)
, (10.5)
Подставляя значения h в формулу (10, 3), получим
 , (10.6)
, (10.6)
т.е. прочность глины обратно пропорциональна ее влажности в кубе.
Отношение прочностей образца глины различной влажности можно записать в виде
 , (10.7)
, (10.7)
а прочность образца любой влажности f i
 , (10.8)
, (10.8)
где f - начальная прочность образца глины; К - начальная влажность образца, Кi влажность насыщенного водой образца.
Экспериментальные данные подтверждают полученные расчеты (табл.10.1).
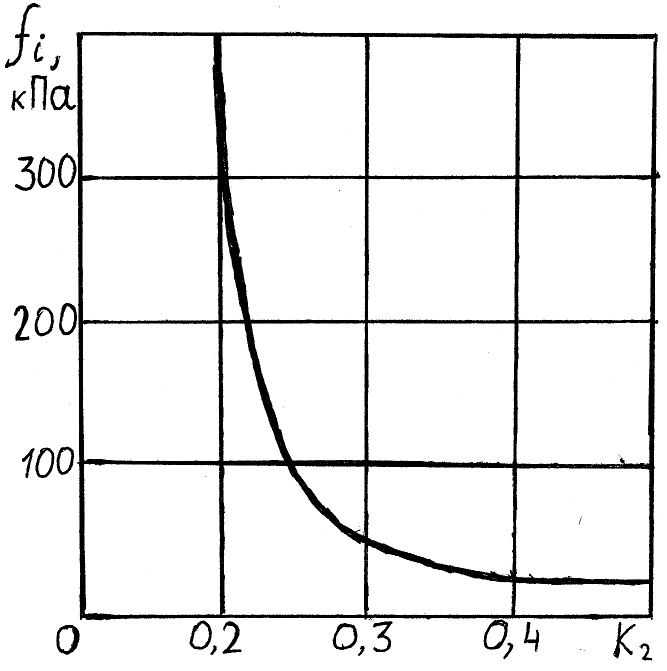
Прочность «сухих» уплотненных пород с весьма тонкими водными пленками (h) во многих случаях не уступает прочности других осадочных пород: известняков, песчаников. С увеличением толщины гидратной пленки межмолекулярное взаимодействие между частицами резко понижается, понижается и пластическая прочность глины (рис.10.5). Прочность гидратной пленки с уменьшением толщины быстро возрастает. У самой поверхности частицы сила взаимодействия молекул воды достигает тысяч кг/см2 (см. часть 1, 3.3). С удалением от частицы эти силы снижаются обратно пропорционально расстоянию в седьмой степени.
Таблица 10.1
Зависимость пластической прочности образца глины от влажности К2
| Показатели опытов | Время набухания | |||||||
| 0, 25 | 0, 50 | 1, 0 | 3, 0 | 24, 0 | 120, 0 | 192, 0 | 300, 0 | |
| Влажность К, см3/г | 0, 174 | 0, 222 | 0, 273 | 0, 340 | 0, 418 | 0, 484 | 0, 648 | 0, 700 |
| Пластическая прочность f i, МПа | 0, 3806 | 0, 1830 | 0, 1016 | 0, 0409 | 0, 0285 | 0, 0196 | 0, 0168 | 0, 0140 |
 Расчетное значение f i, МПа Расчетное значение f i, МПа
| 0, 3806 | 0, 1832 | 0, 0985 | 0, 0510 | 0, 0275 | 0, 0177 | 0, 0074 | 0, 0058 |
|
|
