
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Необратимый гидролиз
|
|
Если соль образована слабой кислотой и слабым основанием, то такая соль нередко разлагается водой до конца (выпадает осадок, выделяется газ). Если все же водный раствор соли существует, то его кислотность зависит от того, чья константа диссоциации (основания или кислоты) больше. Когда выше значение константы диссоциации кислоты, раствор обычно слабокислый, а когда основания – слабощелочной.
В некоторых случаях гидролиз солей протекает особенно сильно и степень гидролиза достигает почти 100%. Такие соли в водных растворах не существуют, а хранятся только в сухом виде. В таблице растворимости против них стоит прочерк. Примерами таких солей могут служить ВаS, Аl2S3, Сr2(SO3)3 и другие (см. таблицу растворимости в приложении). Подобные соли, имеющие высокую степень гидролиза, гидролизуются полностью и необратимо, т. к. продукты их гидролиза выводятся из раствора в виде малорастворимого, нерастворимого, газообразного (летучего), малодиссоциирующего вещества или разлагаются водой на другие вещества. Соли, полностью разлагаемые водой, нельзя получить реакцией ионного обмена в водных растворах, т.к. вместо ионного обмена более активно протекает реакция гидролиза. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно в какой-то степени растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой.
К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты. Например:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
2АlCl3 + 3Na2S = Аl2S3 + 6NaCl (так могло бы быть), но вследствие гидролиза
2АlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaCl (так есть фактически).
Соли, подобные Al2S3, получают в безводных средах спеканием компонентов в эквивалентных количествах или другими способами.
CaS + 2H2O = Ca(OH)2 + H2S.
3Na2SiO3 + 2AlCl3 + 6H2O = 3H2SiO3 + 2Al(OH)3 + 6NaCl.
Причина этой реакции заключается в смещении равновесий в реакциях в сторону продуктов реакции:
SiO32- + H2O ↔ HSiO3- + OH-,
Al3+ + H2O 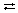 AlOH2+ + H+
AlOH2+ + H+
в результате необратимого взаимодействия гидроксид - иона с ионом водорода: Н+ + ОН– = H2О.
Итак, допустим, что в разных сосудах установились равновесия:
CO32– + H2O  HCO3– + OH–,
HCO3– + OH–,
Al3+ + H2O  AlOH2+ + H+.
AlOH2+ + H+.
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле-Шателье оба равновесия смещаются вправо, и гидролиз протекает полностью:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl.
Это называется взаимным усилением гидролиза.
|
|
