
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водопроводная вода
|
|
Россия богата водными ресурсами: в ней сосредоточено более 20 % мировых запасов пресных поверхностных и подземных вод. Источниками водоснабжения в большинстве регионов РФ являются поверхностные воды рек и озер, на долю которых приходится 65—68 % от общего объема водозабора. Подземные воды на территории РФ используются достаточно неравномерно. Вода из артезианских скважин составляет более 70 % общего водозабора в Брянской, Владимирской, Смоленской, Тульской, Орловской и некоторых других областях. Менее 20 % составляет водозабор подземных вод в Новгородской, Архангельской, Мурманской, Костромской, Ярославской и некоторых других областях с неблагоприятными для этого гидрогеологическими условиями.
Несмотря на богатые водные ресурсы, более половины населения страны пользуется недоброкачественной питьевой водой, содержащей значительные количества 3В. Особенно тяжелое положение с загрязнением поверхностных источников сложилось в Астраханской, Кемеровской, Калининградской, Томской, Тюменской, Ярославской, Курганской областях и Приморском крае.
Получение питьевой воды. Технология очистки воды с забором из поверхностных источников чаще всего включает последовательное проведение следующих стадий: а) предварительное хлорирование; б) реагентная обработка солевым коагулянтом и отстаивание; в) осветление (фильтрование) на песчаных фильтрах; г) хлорирование. С середины 1980-х годов па некоторых зарубежных водопроводных станциях Англии, Австралии и других стран стали включать обязательное фильтрование воды через загрузку с активированным углем, обеспечивающим удаление из воды органических примесей.
При заборе воды из подземных источников, имеющей, как правило, незначительную мутность и повышенное солесодержание, не используют солевые коагулянты, а применяют специальные технологические приемы (обезжелезивание, удаление сероводорода, деманганация и др.). Иногда подземные воды соответствуют нормативным требованиям, тогда процесс водоподготовки значительно упрощается.
Природные воды — сложные многокомпонентные системы, содержащие частицы различной дисперсности (взвесь, коллоиды, молекулы, ионы). В зависимости от природы содержащихся в воде примесей различают мутные и цветные воды. В мутных водах преобладают неорганические примеси (кремниевая кислота, алюмосиликаты), находящиеся во взвешенном (дисперсном) состоянии. Цветность природных вод обусловлена присутствием солей железа гуминовых и фульвокислот, находящихся в коллоидном или истинно растворенном состоянии.
Осветление воды производится с использованием коагулянтов[23].
Обработкой воды коагулянтами можно также устранить до 80-90 % веществ, обусловливающих цветность воды, видимо, за счет их сорбции на поверхности продуктов гидролиза коагулянтов.
В качестве коагулянтов в водоподготовке применяют соли поливалентных металлов - сернокислый алюминий А12(SO4)3*18Н2O, сульфат закисного железа FеSO4*7Н2O, хлорное железо FеСl3*7Н2О и некоторые другие. Попадая в воду, солевые коагулянты гидролизуются с образованием труднорастворимых оснований или основных солей, например:
 FеСl3 + 3Н2О Fе(ОН)3+ 3НС1
FеСl3 + 3Н2О Fе(ОН)3+ 3НС1
 Fе3+ + 3Н2О Fе(ОН)3 + 3Н+
Fе3+ + 3Н2О Fе(ОН)3 + 3Н+
Процесс гидролизасолевого коагулянта сопровождается выделением кислоты, которая для смещения равновесия должна быть связана. В природной воде связывание ионов водорода происходит согласнореакции:
 Н+ + НСО3- CO2 + Н2О
Н+ + НСО3- CO2 + Н2О
Наличие бикарбонат-ионов в воде является необходимым условием для обеспечения глубокого протекания процесса гидролиза. При малой щелочности исходную воду подщелачивают известью, едким натром или содой.
Агрегативная устойчивость коллоидных систем объясняется существованием двойного электрического слоя ионов и скачка потенциала на границе раздела фаз. Возникновение заряда у коллоидных частиц обусловливается избирательной адсорбцией ионов определенного знака из дисперсионной среды или же диссоциацией поверхностных молекул, образующих частицу. Обычно ядро коллоидной частицы адсорбирует ионы, в составе которых находятся элементы или атомные группировки, имеющиеся в веществе ядра частицы (правило Пескова-Фаянса).
Коллоиднаячастица (мицелла) в целом электронейтральна, таккак к ней притягиваются ионы противоположного знака. Таким образом, вокруг частицы возникает двойной электрический сдой, внутренняя обкладка которого расположена на поверхности частицы, а внешняя граничит с жидкостью, окружающей частицу. Этот внешний слой называется диффузным, причем его заряд будет равен и противоположен по знаку заряду частицы. Концентрация противоионов максимальна у поверхности (плотный ионный слой) и убывает с увеличением расстояния от поверхности частицы. Структуру мицеллы Fе(ОН)3, образовавшуюся при гидролизе FеС13 (слабокислая или нейтральная среда), можно представить формулой



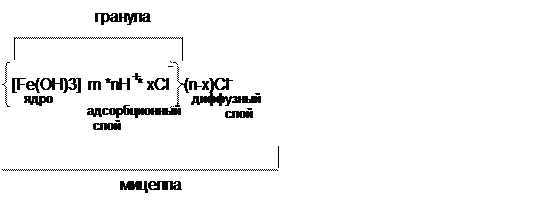
Гидроксиды железа или алюминия, образовавшиеся в результате протекания гидролиза и находящиеся вначале в коллоидном состоянии, имеют положительно заряженные частицы (гранулы). Основная масса коллоидных частиц природной воды имеет отрицательный заряд. За счет взаимной нейтрализации частиц нарушается их агрегативная и кинетическая устойчивость, происходит слипание и седиментация (взаимная коагуляция коллоидов).
Процесс коагуляции имеет две стадии - скрытую и явную.Наскрытой стадии происходит формирование коллоидного раствора Fе(ОН)3 и образование микрохлопьев. Именно на этой стадии коагуляции вода в основном и очищается от первичных коллоидных примесей; на следующей, второй, стадии процесса, образуются крупные хлопья (флокулы) размером 1-3 мм, которые, обладая высокой сорбционной способностью, дополнительно извлекают примеси из воды.
Большое влияние на процесс коагуляции оказывает температура и режим перемешивания. При повышении температуры увеличивается скорость и глубина гидролиза, скорость формирования и отделения твердой фазы, что в конечном результате ускоряет и углубляет коагуляцию примесей. Для интенсификации процесса коагуляции в обрабатываемую воду вводят специальные вещества - флокулянты. Сущность процесса флокуляции состоит в том, что агрегация коллоидных частиц в этом случае происходит не только непосредственно, но и через молекулы флокулянта. В качестве флокулянтов используют неорганические (активная кремнекислота) или органические высокомолекулярные соединения, среди которых наиболее широкое применение получил полиакриламид.
За счет отстаивания (седиментации) не удается получить воду с концентрацией твердой фазы менее 10 мг/л, поэтому воду дополнительно подвергают фильтрованию через насыпные фильтры. В качестве фильтрующих материалов чаще всего используют кварцевый песок. После насыщения фильтра взвесью его регенерируют (промывают) обратным током воды.
Обеззараживание воды. Опасность заболеваний человека от микробиологического загрязнения воды многократно выше, чем при ее загрязнении химическими веществами различной природы. Большинство микроорганизмов безвредно для человека, а некоторые из них даже полезны. Однако в воде существуют микробы и вирусы, являющиеся причиной тяжелых инфекционных заболеваний (брюшной тиф, дизентерия, холера, вирусный гепатит, полиомиелит, менингит, сибирская язва и др.), а также яйца гельминтов. Чаще всего ими бывают богаты канализационные сточные воды, а кишечная палочка, живущая в кишечнике человека, является индикатором загрязнения воды канализационными стоками, так как она наименее чувствительна к обеззараживающим агентам по сравнению с возбудителями инфекционных заболеваний.
На завершающем этапе очистки питьевой воды, в целях обеспечения эпидемической безопасности, ее подвергают обеззараживанию. Наиболее стойкими к обеззараживающим факторам, по сравнению с бактериями и вирусами, являются не так давно открытые гигиенистами простейшие Гьярдия и Криптоспоридия, а также инфицирующие цисты. Следует отметить малую эффективность применяемых методов обеззараживания против энтеровирусов.
Обеззараживание воды осуществляют с помощью химических реагентов, чаще всего окислителей (галогены и их соединения, озон, пероксид водорода, перманганат калия, ионы серебра, меди и др.), с помощью физических факторов, а также с помощью получивших широкое развитие в последнее время мембранных методов очистки воды.
Несмотря на разнообразие обеззараживающих средств, во всем мире в 99 случаях из 100 для дезинфекции воды используют хлор или хлорсодержащие продукты. Никакой другой метод не оказывает такого длительного бактерицидного действия (см. лаб. работу «Определение остаточного хлора»).
Кроме хлора и его соединений для обеззараживания могут быть использованы другие галогены - бром, йод и их соединения. Бром обеспечивает высокую степень дезинфекции, не дает неприятных запахов, эффективен против водорослей, не раздражает глаза, не образует тригалометанов, удачно подходит для обеззараживания воды бассейнов. ПДК для образующегося в процессе дезинфекции бромид-иона 0, 2 мг/л, его токсическая доза для человека - около 3 г, летальная — более 35 г. В относительно высоких концентрациях бромид-ионы угнетают деятельность щитовидной железы.
Йод аналогичен по дезинфицирующему действию брому. В воде он гидролизуется гораздо меньше, чем хлор: I2 + Н2О = HIО + HI. Необходимая для обеззараживания доза йода при рН< 7 составляет 0, 3-1 мг/л, а неприятный запах йода в воде обнаруживается при его концентрации лишь более 1, 5 мг/л. Наличие в воде органических веществ, аммиака или аммонийных солей мало снижает бактерицидные свойства йода, так как последний не образует йодаминов и очень медленно реагирует с органическими веществами природных вод. Йод является жизненно важным элементом и обладает высокой биологической активностью. ПДКрх для йодид-иона составляет 0, 4 мг/л; порог токсичности йода равен 5 мг/сутки. Дезинфекция йодом, однако, обходится в 15-20 раз дороже, чем дезинфекция хлором.
Мнение об озонировании, как о более безвредном способе обеззараживания воды, которым механически можно заменить хлорирование, поверхностно и ошибочно. Продукты реакций озона с органическими веществами представляют собой альдегиды, кетоны, карбоновые кислоты и-другие небезобидные соединения, обусловливающие вторичное загрязнение воды. Фенолы под действием озона расщепляются с образованием альдегидов, глиоксаля, щавелевой и дикарбоновых кислот. Выделяющиеся при озонировании органические соединения являются питательной средой для микроорганизмов, которые, попадая в системы распределения воды, при этом бурно размножаются. Озонирование также требует дополнительной очистки от образующихся побочных продуктов и не обеспечивает защиту от повторного загрязнения.
Из препаратов индивидуального обеззараживания воды наиболее распространены органические хлорамины и йодорганические соединения. К хлораминам относится пантппид, одна таблетка которого содержит 3 мг активного хлора и при растворении обеззараживает около 750 мл прозрачной воды в течение- 30 минут. Значительно эффективнее пантоцида йодорганические соединения в смеси с виннокаменной кислотой. Для обеззараживания небольших количеств воды могут быть использованы также пероксид водорода Н2О2 или перманганат калия КМnO4. Дезинфицирующее действие перманганата калия значительно слабее, чем хлора из-за его активного взаимодействия с органическими и неорганическими веществами.
Обеззараживание под действием физических факторов (кипячение, облучение ультрафиолетом, обработка ультразвуком) исключает введение химических веществ в очищаемую воду и характеризуется во всех случаях отсутствием пролонгированного обеззараживающего эффекта. Достаточно широко используемое УФ-облучение эффективно только при обеззараживании прозрачной воды, не содержащей взвесей.
Кипячение воды связано с большими энергозатратами, обусловленными фазовым переходом жидкость - пар. Кипячение жесткой воды с последующим ее охлаждением и отстаиванием, помимо обеззараживающего эффекта, приводит к образованию осадка карбонатов кальция и магния в соответствии с уравнениями реакций:
Са(НСО3)2=СаСО3↓ +СО2↑ + Н2О
Mg(НСО3)2=MgСО3↓ +СО2↑ + Н2О
Образующиеся осадки имеют высокоразвитую поверхность; они адсорбируют и увлекают с собой ионы тяжелых металлов (Fе, Ni, Рb и др.) и многие другие микропримеси, обеспечивая эффективную очистку воды и ее умягчение (на 25-35 % и более) без применения, каких-либо дорогостоящих материалов и приспособлений. Явным показателем очистки воды от ионов железа является рыжеватый цвет отстоявшегося осадка или отложившейся накипи.
При относительно небольших расходах воды в последнее время для ее очистки широко используют фильтрование через мембраны с различными размерами пор.
Микрофильтрацня обеспечивает удаление из воды только взвешенных веществ, ультрафильтрация - коллоидных частиц и макромолекул (белки, полисахариды и др.), обратный осмос - удаление до 99 % солей и молекул органических веществ. Учитывая относительно большие размеры бактерий (300-10 000 нм), а также то, что вирусы (30-300 нм) чаще всего находятся в адсорбированном состоянии на поверхности бактерий или взвешенных частиц, мембранные технологии обеспечивают стерилизацию воды одновременно с ее очисткой. Обеззараживающий эффект возрастает с уменьшением пор в используемых мембранах в ряду микро-, ультра- и гиперфильтрации.
Для осуществления фильтрационных процессов широко используются полимерные, а также более долговечные керамические мембраны. Необходимое для фильтрования давление колеблется в пределах от 10—60 (обратный осмос) до 2 и менее атмосфер (микрофильтрация). При использовании мембранных технологий исключаются многие технологические недостатки, как хлорирования, так и других методов обеззараживания.
Обезжелезивание воды (см.лаб. работу «Определение железа»).
Удаление марганца. Марганец в природных водах может находиться в виде различных соединений. В подземных водах он преимущественно находится в виде бикарбоната Мn(НСО3)2, хорошо растворимого в воде. Концентрация ионов Мn2+ в подземных водах обычно колеблется в пределах от 0, 5 до 2-3 мг/л. В поверхностных водах, содержащих гумусовые соединения, марганец может образовывать комплексные органические соединения, в том числе и в коллоидной форме. Содержание марганца в поверхностных водоемах обычно незначительно, однако вследствие загрязнения промстоками может достигать 3-4 мг/л. ПДК марганца для питьевой воды и воды рыбохозяйственных водоемов составляет 0, 1 и 0, 01 мг/л соответственно.
Двухвалентный марганец медленно окисляется кислородом, растворенным в воде, до 3- или 4-валентного состояния. 3- и 4-валентный марганец гидролизуется с образованием осадков, соответственно Мn(ОН)5 и Мn(ОН)4 (точнее МnО2*хН2О), растворимость которых в воде при рН> 7 не превышает 0, 01 мг/л.
Скорость окисления Мn2+ растворенным кислородом в очень сильной степени зависит от значения рН воды. При рН< 8 без катализаторов окисление Мn2+ практически не происходит, а достаточно быстрое окисление наблюдается лишь при значениях рН> 9, 5. Процесс окисления 2-валентного марганца резко ускоряется при контакте аэрированной воды с дробленным пиролюзитом, марганцевым катионитом или осадком Мn(ОН)2, предварительно окисленным аэрацией.
При фильтровании аэрированной и предварительно подщелоченной воды, содержащей ионы Мn2+, через насыпной песчаный фильтр, поверхность песчинок которого покрыта отрицательно заряженным осадком Мn(ОН)4, последний адсорбирует ионы Мn2+. Эти ионы гидролизуются и реагируют с ранее выпавшим осадком, образуя Мn2O3:
 Мn(ОН)4+ Мn(ОН)2 Мn2O3+ 3Н2О
Мn(ОН)4+ Мn(ОН)2 Мn2O3+ 3Н2О
Последний легко окисляется растворенным в воде кислородом с образованием Мn(ОН)4, который снова участвует в процессе окисления, являясь катализатором:
 2 Мn2O3 + 8 Н2О + О2 4Мn(ОН)4
2 Мn2O3 + 8 Н2О + О2 4Мn(ОН)4
Одновременная очистка воды от ионов марганца и железа может быть осуществлена ее обработкой перманганатом калия, в результате которой образуются осадки, соответственно МnО2*хН2О и Fе(ОН)3:
 3Мn2+ + 2МnO4- + 2Н2О 5МnO2 ↓ + 4H+
3Мn2+ + 2МnO4- + 2Н2О 5МnO2 ↓ + 4H+
 3Fе2+ + МnO4- + 7 Н2О 3 Fе(ОН)3 ↓ + МnO2 ↓ + 5H+
3Fе2+ + МnO4- + 7 Н2О 3 Fе(ОН)3 ↓ + МnO2 ↓ + 5H+
Марганец относится к важнейшим биогенным микроэлементам, входя в состав множества ферментов и участвуя в выполнении разнообразных функций в организме (синтез и обмен нейромедиаторов, обеспечение стабильности клеточных мембран, функционирование мышечной ткани, обмен гормонов щитовидной железы и др.). Среднесуточная потребность человека в марганце составляет 2—5 мг. Оптимальная интенсивность поступления марганца в организм - 3-5 мг/день; уровень, приводящий к дефициту, и порог токсичности оценивается в 1 и 40 мг/день соответственно. Период полувыведсния марганца из организма составляет 4-40 суток.
Обесфторивание и фторирование воды. Избыток фтора в питьевой воде (ПДК=1, 5 мг/л) при длительном ее употреблении вызывает флюороз зубов. В районах недостаточного поступления йода в организм человека избыток фтора в питьевой воде может вызывать заболевание щитовидной железы в результате вытеснения фтором йода в ее тканях. При многолетнем использовании воды с содержанием фтора более 5 мг/л, особенно в условиях жаркого климата, может произойти обызвествление сухожилий и связок (флюороз скелета). Оптимальной концентрацией ионов фтора в питьевой воде считается 1 мг/л.
Содержание фтора в природных водах чаще всего колеблется в пределах 0, 3-0, 4 мг/л, но может достигать и 12 мг/л.
Удаление ионов фтора за счет образования осадков малорастворимых фторидов является безуспешным в связи с относительно высокой растворимостью последних.
Методы обесфторивания воды основаны на использовании селективных по отношению к фтор-ионам анионитов (активированная окись алюминия, гидроксилапатит) или сорбентов (свежевыделенные осадки гидроксидов магния, алюминия или фосфата кальция). Наилучшие результаты обесфторивания имеют место при использовании активированной окиси алюминия.
В процессе обесфторивания воды на активированной сернокислым алюминием окиси алюминия происходит ионный обмен в строго эквивалентных соотношениях по следующим схемам:
[Аn]2SO4 + 2F- = 2[Аn]F + SO42-
[Аn]2SO4 + 2НСО3- = 2[Аn]НСО3-+ SO42-
Благодаря селективным свойствам активированной окиси алюминия поглощение фтор-ионов происходит гораздо интенсивнее, чем бикарбонат-ионов, несмотря на то что концентрация последних значительно выше.
Фтор жизненно необходим для нормального роста и развития организма. При недостатке фтора в рационе людей наблюдается распространение кариеса, приводящего к потере зубов. Содержание фтора в теле взрослого человека составляет около 2, 6 г, причем 99 % его количества приходится на кости и зубную эмаль. Среднесуточное поступление фтора с пищей составляет 0, 5—1, 5 мг. Токсическая доза фтор-ионов для человека составляет 20 мг, летальная - около 2 г. Период полувыведения фтора из организма составляет 808 суток.
Удаление сероводорода. Сероводород содержится в некоторых подземных водах, придавая им неприятный запах при концентрации Н2S более 0, 5 мг/л. В зависимости от величины рН сероводород в водных растворах находится в виде молекулярного Н2S или ионов НS- при значениях рН более 10 в воде появляются ионы S2-. Предельно допустимые концентрации Н2S и НS- для питьевой воды соответственно равны 0, 003 и 3, 0 мг/л.
Вода, содержащая Н2S, обладает повышенной коррозионной активностью по отношению к металлическим трубам и бетону. Сероводород образует с кальцием, содержащимся в бетоне, растворимый Са(НS)2, который вымывается водой. При взаимодействии продуктов окисления сероводорода с кальцием образуется сульфоалюминат кальция, удельный объем которого многократно превышает удельный объем бетона, что также приводит к его разрушению.
Для очистки воды от сероводорода могут быть использованы четыре варианта осуществления технологических процессов:
1) физический метод - аэрация;
2) химические методы, основанные на окислении Н2S, осаждении сульфида железа или использовании окислительно-восстановительных анионитов;
3) физико-химические методы, основанные на подкислении воды и последующей аэрации;
4) биохимический метод с использованием бактерий, окисляющих сероводород в процессе своей жизнедеятельности.
Применение аэрации для очистки эффективно при значениях рН менее 5, когда сероводород находится в молекулярной форме, так как ионы НS-непосредственно аэрацией не удаляются. В связи с переходом молекул Н2S из жидкой фазы в газообразную при аэрационной очистке воды происходит загрязнение сероводородом атмосферного воздуха.
 Наряду с десорбцией при аэрации также происходит окисление части Н2S до серы: 2 Н2S + О2 2S↓ + 2Н2О
Наряду с десорбцией при аэрации также происходит окисление части Н2S до серы: 2 Н2S + О2 2S↓ + 2Н2О
Процесс окисления может в небольшой степени идти и дальше до образования тиосульфатов S2O32-; дальнейшее окисление S2O32- до сульфитов и сульфатов аэрацией при отсутствии серных бактерий обычно не идет. Способность к окислению различных форм сероводорода уменьшается с ростом значения рН, и окисление до сульфатов идет только в кислой среде.
Аэрацию воды целесообразно применять при содержании Н2S до 2-3 мг/л и значениях рН < 6, 5-7, тогда его концентрация снижается до 0, 3-0, 5 мг/л. Окончательную очистку воды можно произвести путем окисления Н2S, например, хлором, озоном, пероксидом водорода, перманганатом калия. Окислители обычно используются для очистки воды, содержащей небольшие концентрации сероводорода.
При высоких концентрациях Н2S (более 200 мг/л) для очистки может быть использована суспензия Fе(ОН)3, при добавлении которой в воде выпадает осадок FеS:
 3Н2S + 2Fе(ОН)3 2FеS ↓ + S↓ + 6Н2О
3Н2S + 2Fе(ОН)3 2FеS ↓ + S↓ + 6Н2О
 3НS- + 2Fе(ОН)3 + 3Н+ 2FеS↓ + S↓ + 6Н2О
3НS- + 2Fе(ОН)3 + 3Н+ 2FеS↓ + S↓ + 6Н2О
После осветления воды, например в отстойниках, осадок FеS может быть регенерирован продувкой воздухом и вновь использован:
 4FеS + 3О2 + 6Н2O 4Fе(ОН)3 ↓ + 4S ↓ (Мешалкин, 2007)
4FеS + 3О2 + 6Н2O 4Fе(ОН)3 ↓ + 4S ↓ (Мешалкин, 2007)
|
|