
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическое введение
|
|
При растворении некоторых солей в воде нарушается равновесие диссоциации воды. Это является результатом обменных реакций растворенного вещества с растворителем, приводящих к образованию труднорастворимых, газообразных и малодиссоциирующих соединений. Такое обменное взаимодействие растворенного вещества с водой называется гидролизом.
В зависимости от природы растворенного вещества, его гидролиз может происходить по-разному. Так если соль образована сильной кислотой и основанием равной силы, то она полностью распадается в воде на свои составные части, а ее катионы и анионы, сталкиваясь с ионами Н+ и ОН-, практически ими не связываются. Происходит это по тому, что получающиеся в результате такого столкновения сильные кислота и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической диссоциации воды не смещается, концентрация ионов водорода и гидроксида остается постоянной, равной 10-7моль/литр.
Гидролизу подвергаются все остальные соли:
· образованные катионом сольного основания и анионом слабой кислоты – происходит гидролиз по аниону;
· образованные катионом слабого основания и анионом сильной кислоты – происходит гидролиз по катиону;
· образованные катионом слабого основания и анионом слабой кислоты – происходит гидролиз и по катиону и по аниону.
Процесс гидролиза количественно характеризуется степенью гидролиза (h) и константой гидролиза (К г). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу (С гидр.), к общему числу растворенных молекул (С общ.):

Степень гидролиза зависит от следующих факторов:
1. природы соли;
2. ее концентрации;
3. температуры раствора.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры протекает полнее. Следовательно при гидролизе соблюдается принцип Ле-Шателье. Константой гидролиза (Кг) называется - отношение произведения концентрации продуктов гидролиза к концентрации негидролизованной соли (определяется обычно по таблицам). Величина Кг, в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением аналогичным закону разбавления:
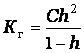
где С – исходная концентрация соли в растворе, (моль/литр).
Если степень гидролиза мала (h < < 1), то К г = h 2* С,
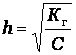
Для воды и ее растворов произведение концентрации ионов Н+ и ОН- величина постоянная при данной температуре и называется ионным произведением воды К в.При 25оС К в = [H+] · [OH-] = 1·10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию одного вида ионов, если известна концентрация другого вида ионов, а именно:


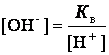
В чистой воде [H+] = [OH-] = 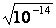 = 10-7 моль/л
= 10-7 моль/л
Концентрация ионов водорода указывает на характер среды:
[H+] = [OH-] = 10-7 моль/л, нейтральная среда;
[H+] > 10-7 моль/л, кислая среда;
[H+] < 10-7 моль/л, щелочная среда.
Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН, он равен отрицательному десятичному логарифму концентрации водородных ионов рН = -lg[H+], следовательно, в щелочной среде рН > 7; в нейтральной среде рН = 7, в кислой среде рН < 7.
Опыт 1.
| № п/п | Формула соли | Окраска лакмуса | Окраска фенол-на | рН раствора | Хар-ер раствора |
| FeCl3 | красный | бесцветный | кислый | ||
| ZnSO4 | фиолетовый | бесцветный | кислый | ||
| Al2(SO4)3 | фиолетовый | бесцветный | кислый | ||
| Na2CO3 | синий | малиновый | щелочной | ||
| Na2S | синий | малиновый | щелочной |
(1) 1)FeCl3 + HOH ↔ FeOHCl2 + HCl
Fe3+ + 3Cl- +H2O ↔ FeOH2+ + 2Cl- + H+ + Cl-
Fe3+ + H2O ↔ FeOH2+ + H+
2)FeOHCl2 + HOH ↔ Fe(OH)2Cl + HCl
FeOH2+ + 2Cl- + H2O ↔ Fe(OH)2+ + Cl- + H+ + Cl-
FeOH2+ + H2O ↔ Fe(OH)2+ + H+
3)Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
(2) 2ZnSO4 + 2H2O = (ZnOH)2SO4 + H2SO4
Zn2+ + H2O = ZnOH+ + H+
(ZnOH)2SO4 + 2H2O = 2Zn(OH)2 + H2SO4
ZnOH+ + H2O = Zn(OH)2 + H+
(3) Al2(SO4)3 + HOH =2Al 3+ + 3SO4 2- + HOH = AlOH 2+ + H+ + 3SO42- + Al
Al 3 + + HOH = AlOH 2+ + H+
(4)
Опыт 2.
(Б) Na2SO3 + H2O = NaOH + NaHSO3
SO32- + H2O = OH- + HSO3-
pH > 7, щелочная среда
сульфит натрия подвергается неполному гидролизу, образуется кислая соль.
Опыт 3.
(А)
| № п/п | Формула соли | Цвет фенол-на | Цвет лакмуса | рН |
| Na2SO3 | малиновый | ----- | ||
| CH3COONa | бесцветный | ----- | ||
| Na2CO3 | малиновый | ----- | ||
| Al2(SO4)3 | ----- | красный | ||
| MgSO4 | ----- | бурый |
|
|