
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фотоколориметрия
|
|
Цель работы.
1. Познакомиться с фотоколориметрическим методом анализа.
2. Провести цементацию меди из сернокислого раствора.
3. Определить степень цементации.
Оборудование и реактивы
Магнитная мешалка.
Раствор сульфата меди концентрации 10 г/л.
Порошок цинка или железа.
Эталонный раствор с содержанием меди 1 мг/мл.
Двунормальный раствор аммиака.
Соляная кислота, 2%.
Фотоколориметр.
Общие положения
Цементацией называется процесс вытеснения металлов из растворов, основанный на электрохимической реакции между металлом-цементатором и ионом вытесняемого металла:
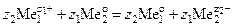 .
.
Термодинамическая возможность и направление протекания цементации определяется соотношением величин электродных потенциалов. Вытесняющий металл должен иметь более отрицательный электродный потенциал, чем вытесняемый: 
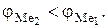
 По мере выделения металла меняется его концентрация, а, следовательно, и величина потенциала. При равновесии
По мере выделения металла меняется его концентрация, а, следовательно, и величина потенциала. При равновесии 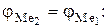
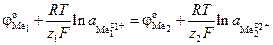
или
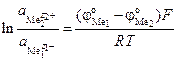 ,
,
где 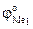 и
и  – стандартные потенциалы Me1 и Me2,
– стандартные потенциалы Me1 и Me2,
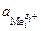 – активности ионов металлов в растворе,
– активности ионов металлов в растворе,
F = 96487 Кл/г-экв – число Фарадея.
Медь практически полностью восстанавливается из раствора при цементации цинком 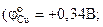
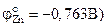 . Цементация меди железом при комнатной температуре протекает очень медленно. При погружении металла-цементатора в раствор, содержащий ионы вытесняемого металла, начинается электрохимическое взаимодействие, в результате которого образуются участки поверхности, покрытые восстанавливаемым металлом, - катодные участки. Одновременно возникают анодные участки, где протекает процесс ионизации атомов металла-цементатора.
. Цементация меди железом при комнатной температуре протекает очень медленно. При погружении металла-цементатора в раствор, содержащий ионы вытесняемого металла, начинается электрохимическое взаимодействие, в результате которого образуются участки поверхности, покрытые восстанавливаемым металлом, - катодные участки. Одновременно возникают анодные участки, где протекает процесс ионизации атомов металла-цементатора.
Гетерогенный процесс цементации состоит из нескольких последовательных стадий, из которых главными являются доставка ионов к катодной поверхности и отвод ионов от анодной поверхности; электрохимическое превращение. Скорость цементации и лимитирующие стадии процесса меняются во времени вследствие изменения концентрации раствора и поверхности катодных и анодных участков. В разные периоды процесс может протекать в кинетической, диффузионной или промежуточной областях, а удельная скорость процесса (в расчете на единицу поверхности) может быть описана общим выражением гетерогенного процесса:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
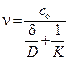 ,
,
где со - концентрация ионов Me1 в объеме раствора; 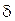 - эффективная толщина диффузионного слоя; D - коэффициент диффузии; К - константа скорости электрохимической реакции.
- эффективная толщина диффузионного слоя; D - коэффициент диффузии; К - константа скорости электрохимической реакции.
Скорость цементации зависит от активности металла - цементатора, электрохимических потенциалов  и температуры процесса.
и температуры процесса.
Кроме основных реакций в процессе цементации при определенных условиях могут протекать побочные реакции выделения водорода и катодное восстановление кислорода, что приводит к дополнительным затратам и обратному растворению осажденного металла.
Фотоколориметрия
Фотоколориметрия – это оптический метод определения концентрации окрашенных растворов, основанный на избирательном поглощении ими света строго определенных длин волн.
Та или иная окраска вещества обусловлена тем, что оно избирательно поглощает излучение в видимой области спектра, то есть в диапазоне длин волн от 380 до 750 нм.
В основе фотоколориметрического анализа лежит закон поглощения света, который был открыт в 1729 г. П. Бугером и изучен И.Г.Ламбертом. Согласно ему ослабление интенсивности монохроматического излучения экспоненциально зависит от толщины поглощающего слоя. В 1852 г. А.Бер выяснил роль химической природы поглощающего вещества и его концентрации.
Закон Бугера-Ламберта-Бера выражается уравнением:
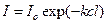
где 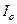 и
и 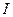 – интенсивность падающего и прошедшего пучка монохроматического излучения соответственно,
– интенсивность падающего и прошедшего пучка монохроматического излучения соответственно,
k – коэффициент, зависящий от химической природы поглощающего вещества,
l-толщина поглощающего слоя,
с – концентрация поглощающего вещества в растворе.
В фотоколориметрических измерениях обычно пользуются логарифмической формой этого уравнения и выражают ослабление излучения как оптическую плотность.
D = ε lc,
где D – оптическая плотность окрашенного раствора,
D = -(lg I/Io).
При проведении фотоколориметрического анализа величины k и l остаются постоянными. Поэтому, измерив на опыте оптическую плотность окрашенного раствора, можно определить его концентрацию.
Прибор для фотоколориметрических измерений – фотоэлектроколориметр. Его оптическая схема включает следующие основные узлы:
1) источник белого полихроматического света – лампа накаливания с вольфрамовой нитью;
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
2) набор светофильтров – окрашенных стекол, пропускающих излучение определенного узкого интервала длин волн;
3) кюветы для растворов – прямоугольные сосуды из кварцевого стекла, прозрачные в видимой области;
4) приемник излучения – фотоэлемент.
Подробное описание прибора и правила работы на нём даны в Приложении.
Образцы для фотоколориметрического анализа готовят в виде разбавленных окрашенных растворов.
Порядок проведения фотоколориметрических измерений следующий:
- приготовление окрашенного раствора,
- выбор светофильтра,
- выбор кюветы,
- построение калибровочного графика,
- нахождение концентрации анализируемого раствора.
Приготовление окрашенного раствора необходимо в том случае, если анализируемое вещество находится в неокрашенной или слабо окрашенной форме. Для его перевода в окрашенную форму проводят реакцию с фотометрическим реагентом (ФМР) – веществом, которое образует интенсивно окрашенные комплексные соединения с анализируемым ионом. ФМР должен обладать избирательным действием в выбранной реакции, то есть не должен давать мешающих окрашенных соединений с другими компонентами раствора. Реакция с ФМР должна проходить быстро, а её равновесие должно быть сдвинуто в сторону окрашенного продукта. Для этого ФМР берут в избытке, создают определенный рН среды, иногда раствор нагревают.
Необходимо иметь в виду, что со временем окраска может меняться, поэтому следует соблюдать постоянство выдержки раствора во времени до момента измерения оптической плотности.
Выбор светофильтра необходим для уменьшения погрешности измерений. Длина волны излучения, на которой проводятся измерения оптической плотности, должна соответствовать максимальному светопоглощению окрашенного раствора.
Выбор кюветы, как и выбор светофильтра, влияет на погрешность измерений. Рабочая длина кювет определяет толщину поглощающего слоя раствора. Она должна быть такой, чтобы оптическая плотность анализируемых растворов на выбранном светофильтре лежала в пределах от 0, 2 до 0, 7. Для темноокрашенных растворов используют кюветы длиной 1…3 мм, а для слабоокрашенных – 30…100 мм.
Построение калибровочного графика основано на том, что согласно закону Бера между концентрацией окрашенного раствора и его оптической плотностью существует прямая пропорциональная зависимость. Для построения калибровочного графика следует приготовить серию из пяти – шести эталонных окрашенных растворов с известными концентрациями анализируемого вещества и определить оптическую плотность каждого из них на выбранном светофильтре. По результатам измерений строят график зависимости оптической плотности (D) от концентрации окрашенного раствора (с). В диапазоне значений D от 0, 2 до 0, 7 он имеет вид прямой линии.
Чтобы найти концентрацию анализируемого раствора сх сначала измеряют его оптическую плотность Dх, а затем по калибровочному графику определяют искомую величину.
Фотоколориметрию применяют для анализа силикатных материалов, сталей и сплавов, для изучения процессов коррозии стали, для определения удельной поверхности и пористости материалов, а также для решения других производственных и научно-исследовательских задач.
|
|
