
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кристаллизация и фазовый состав железоуглеродистых сплавов
|
|
Кристаллизация развивается только при переохлаждении металла ниже равновесной температуры. Процесс кристаллизации начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается при их росте. В зависимости от условий кристаллизации (скорости охлаждения, вида и количества примесей) образуются кристаллы разных размеров от 102 до 106 нм правильной и неправильной формы.
| б» |
В сплавах в зависимости от состояния.различают следующие фазы: жидкие и твердые растворы, химические и промежуточные соединения (фазы внедрения, электронные соединения и др.). Фазой называется физически и химически однородная часть системы (металла или сплава), имеющая одинаковый состав, строение, одно и то же агрегатное состояние и отделенная от остальных частей системы разделяющей поверхностью. Поэтому жидкий металл представляет собой однофазную систему, а смесь Двух различных кристаллов или
одновременное существование жидкого расплава и кристаллов соответственно двух- и трехфазные системы. Вещества, образующие сплавы, называются компонентами.
Твердые растворы представляют собой фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого или других компонентов располагаются в кристаллической решетке первого компонента (растворителя), изменяя ее размеры (периоды). Различают твердые растворы замещения и внедрения. В первом случае атомы растворенного компонента замещают часть атомов растворителя в узлах его кристаллической решетки; во втором они располагаются в межузлиях (пустотах) кристаллической решетки растворителя, причем в тех из них, где имеется больше свободного пространства. В растворах замещения период решетки может увеличиваться или уменьшаться в зависимости от соотношения атомных радиусов растворителя и растворенного компонента; в растворах внедрения - всегда увеличиваться. Твердые растворы внедрения возникают только в случаях, когда диаметры атомов растворенного компонента невелики. Например, в железе, молибдене, хроме могут растзоряться и образовывать-твердые растворы внедрения углерод, азот, водород. Такие растворы имеют ограниченную концентрацию, так как число пор в решетке растворителя ограничено.
В металловедении твердые растворы принято обозначать буквами греческого алфавита а, (3, у н т.д., например, a-Fe, /? -Fe, Микроструктура твердого раствора мало отличается от структуры чистого металла. Все металлы могут в той или иной степени взаимно растворяться в твердом состоянии. Так в алюминии может растворяться до 5, 5% меди, а в меди 39% цинка без изменения кристаллической решетки. Твердые растворы замещения с неограниченной растворимостью могут образовываться в случаях, когда компоненты имеют одинаковые кристаллические решетки; различия в размерах атомов (ионов) не превышают 9-15%, и компоненты принадлежат к одной группе периодической системы или смежным группам. Такой взаимной растворимостью обладают, например, металлы с гранецентрирован- ной кубической решеткой: Ag и Си; Си и Ni; Fe и Со; Fe и Сг; Ni и Pd.
Химические соединения образуются между компонентами, значительно отличающимися электронным строением атомов и кристаллических решеток. В большинстве случаев они не подчиняются законам валентности и не имеют постоянного состава. Например, цементит - Fe^C, содержащий 6, 67% углерода по массе, а также соединения марганца с элементами IV-VI групп периодической системы. Соединения металлов имеют общее название интерметаллидов.
Фазы внедрения - карбиды, нитриды, бориды, гидриды образуются переходными металлами Fe, Мп, Сг, Мо и др. с углеродом, азотом, бсром и водородом, т.е. элементами с малым атомным радиусом. Они имеют много общего в строении и свойствах. В отличие от твердых растворов внедрения, фазы внедрения имеют самостоятельную кристаллическую решетку. Они переменного состава и обладают высокой твердостью.
Электронные соединения образуются между одновалентными элементами (Си, Ag, Аи, Li, Na) или переходными металлами и простыми металлами с валентностью от 2 до 5 (Be, Mg, Zn, Sn, Cd, Al). Они имеют определенную электронную концентрацию (отношение числа валентных электронов к числу атомов) и отличную от компонентов кристаллическую решетку. Соединения этого типа характерны для сплавов меди-латуни (CuZn), оловянистых (Cu3Sn), алюминиевых и бериллиевых бронз.
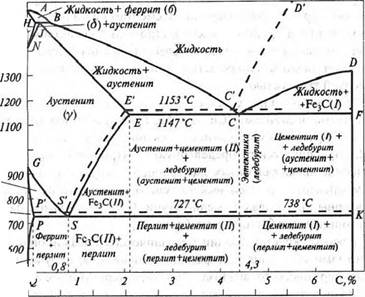
Процесс кристаллизации металлических сплавов описывают диаграммами состояния или фазового равновесия, получаемыми на основе термического анализа. Они характеризуют окончательное состояние сплавов, в которых все фазовые превращения произошли и полностью закончились. На рис. 7.6 приведена диаграмма состояния Fe-Fe3C, которую условно представляют как Fe-C, имея в виду пропорциональное содержание углерода и цементита в сплаве. Вероятность образования метастабильного цементита в жидкой фазе или аустените при обычном и ускоренном охлаждении значительно больше, чем графита. Последний выделяется только при медленном охлаждении сплава (штриховые линии на диаграмме состояния).
Точка А (1539°С) соответствует температуре плавления чистого железа, точка D (1250°С) - температуре плавления цементита Fe3C. Точки N(-1392°C) и G (910°С) соответствуют полиформному превращению а - Fe * Fe. Точка Е (1147°С) характеризует предельную растворимость углерода (2, 14%) в y-Fe. Кристаллизация сплавов начинается при достижении температур, соответствующих линии ликвидус АВСД, а конец затвердевания - по достижении температур соответствующих линии солидус AHJECF. Верхний левый угол диаграммы характеризует аллотропическое превращение а(8) у - Fe при высоких температурах. В интервале температур 1392-1539°С а- Fe нередко обозначается, как 8 -Fe. До точки Кюри (768°С) железо
ферромагнитно; выше парамагнитно. В системе Fe-ЕзС различают следующие фазы: жидкий сплав, твердые растворы - феррит и аусте- нит, цементит и графит.
| 1500 Феррит (6)^ 1400 |
| О 10 20 30 40 50 60 70 80 Рис. 7.6. Диаграмма состояния Fe-Fe3C |
| 90Fc3C, % |
| Аустенит+ +феррит Феррит (а) |
| Феррит (а) + Fe3C(/ll) 5004: |
/, " С 1600
Феррит- твердый раствор углерода в or-Fe. Атомы углерода располагаются в центре граней куба, в вакансиях, на дислокациях. Предельная растворимость углерода в феррите при 20°С «0, 006%, 727°С = 0, 02%, в интервале 1392-1539°С = 0, 1%. В смеси с другими фазами феррит устойчив ниже линии GSK на диаграмме (рис. 6.6) в доэвтектоидных сталях, серых и ковких чугунах. Чистый феррит пластичен, имеет небольшую прочность и твердость, магнитен. < тй = =250 МПа, а, а = 120 МПа, д= 50%, ц/= 80%, НВ 800-900 МПа.
Аустенит - твердый раствор углерода в ^-Fe. Предельная растворимость углерода в аустениге 2, 14% при 1147°С. Атомы углерода располагаются в центре элементарной ячейки и дефектных областях кристалла. Повышенная растворимость углерода в аустените обусловлена большим объемом и числом пор в кристаллической решетке ^-Fe. Аустенит устойчив в железоуглеродистых сплавах при t > 121°С. Легирование его Mn, Cr, Si, Mo и В повышает устойчивость аустенита при охлаждении вплоть до комнатной температуры и
определяет возможность получения закалочных структур - бейнита и мартенсита, при большой толщине проката. Прочность и твердость аустенита в 2, 5-3 раза больше феррита при той пластичности и пределе текучести; он легко наклёпывается, обладает большим температурным коэффициентом теплового расширения.
Цементит - химическое соединение железа с углеродом - карбид железа (Fe3C), содержащий 6, 67% С, имеет сложную ромбическую решетку с плотной упаковкой атомов. Цементит является мета- стабильной фазой, претерпевающей изменения при легировании и термической обработке сплавов. Различают первичный цементит, выделяющийся при кристаллизации из жидкого расплава и вторичный и третичный цементиты, выделяющиеся при распаде аустенита и феррита. Твердость цементита в 3-4 раза больше аустенита и в 9-10 раз - феррита.
Графит - стабильная фаза, выделяющаяся при медленном охлаждении сплава и наличии графитизирующих элементов Si, Ni, Си, А1 и других включений, служащих графитными зародышами. Графит имеет слоистое строение, малую прочность и электропроводность, мягок и хрупок.
Сплавы железа с углеродом, содержащие до 2, 14%, называют сталью, содержащие больше 2, 14% С-чугуном. Принятое разграничение связано с предельной растворимостью углерода в аусте- ните. Стали после затвердевания не содержат легкоплавкой эвтектики -ледебурита (точка С на диаграмме состояния), характерной для чугуна при содержании углерода 4, 3%. При высоком нагреве стали имеют структуру чистого аустенита. На диаграмме состояния (рис. 7.6) область его существования ограничена линиями JESGN. Линия GS соответствует началу выделения феррита, линия CD - первичного, a ES - вторичного цементита. Линия PSK соответствует распаду аустенита и образованию эвтектоидной структуры перлита при концентрации углерода в сплаве 0, 8%. Линия PQ показывает изменение растворимости углерода в низкотемпературном а-феррите и соответствует началу выделения из феррита третичного цементита. Существенное влияние на качество структуры и свойства стали имеют термическая и термомеханическая обработка сплавов в температурных областях, расположенных по обе стороны линий PSK и GSE. В зависимости от процентного содержания углерода железноуглеро- дистые сплавы имеют следующие наименования:
- техническое железо С < 0, 02%,
- доэвтектоидные стали С = 0, 02-0, 8%,
- эвтекгоидные стали С = 0, 8%,
- заэвтектоидные стали С = 0, 8-2, 14%,
- доэвтектические чугуны С = 2, 14-4, 3%,
- эвтектика - ледебурит С = 4, 3%,
- заэвтектические чугуны С = 4, 3-6, 67%.
Сплавы железа с углеродом после окончания кристаллизации имеют различную структуру, но одинаковый фазовый состав; при температурах ниже 727°С они состоят из феррита и цементита. Существует определенная связь между типом диаграммы, пластичными и литейными свойствами сплавов. Твердые растворы имеют низкие литейные свойства и склонность к образованию рассеянной пористости и трещин. Для получения высоких литейных свойств концентрация компонентов в сплавах должна превышать их предельную растворимость в твердом состоянии и приближаться к эвтектическому составу. Поэтому чугуны обладают лучшими литейными свойствами, чем стали. Для обеспечения пластичных свойств сплавов концентрация компонентов поэтому не должна превышать их предельной растворимости при эвтектической температуре.
|
|