
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Растворы. Жидкие Вода, спирты, органические растворители Твердые Сплавы Газообразные Воздух (кислород в азоте)
|
|
| Жидкие Вода, спирты, органические растворители | Твердые Сплавы | Газообразные Воздух (кислород в азоте), смеси газов |
Любой раствор состоит из растворенного вещества (1 или несколько) и растворителя. Тот компонент, который количественно преобладает и находится в том же агрегатном состоянии, что и раствор, называют растворителем. Растворы отличаются от других смесей тем, что частицы растворенного вещества распределяются в растворителе равномерно. Рассматривать мы будем только водные растворы, т.к. они наиболее распространены.
Растворы – это однородные смеси, состоящие из двух или более однородных частей и продуктов их взаимодействия.
Это представление исходило из физической теории растворов. В противоположность этой теории существовала и химическая теория. Основные положения этих теорий можно изобразить в таблице «Теории растворов»:
| Физическая теория | Химическая теория |
| Растворение-результат диффузии (проникновение растворенного вещества в молекулы воды) | Растворение-это химическое взаимодействие растворенного вещества с молекулами воды (т.е. гидратация) |
| Растворы - это однородные смеси | Растворы- это химические соединения- гидраты |
| Сторонники: Вант-Гофф, Аррениус, Оствальд | Сторонники: Менделеев, Каблуков, Кистяковский, Коновалов |
Газы. В отсутствие химического взаимодействия газы смешиваются друг с другом в любых пропорциях, и в этом случае говорить о насыщении нет смысла. Однако при растворении газа в жидкости существует некая предельная концентрация, зависящая от давления и температуры. Растворимость газов в некоторых жидкостях коррелирует с их способностью к сжижению. Наиболее легко сжижаемые газы, например NH3, HCl, SO2, более растворимы, чем трудно сжижаемые газы, например O2, H2 и He. При наличии химического взаимодействия между растворителем и газом (например, между водой и NH3 или HCl) растворимость увеличивается. Растворимость данного газа изменяется с природой растворителя, однако порядок, в котором располагаются газы в соответствии с увеличением их растворимости, остается примерно одинаковым для разных растворителей.
Процесс растворения подчиняется принципу ЛеШателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом ЛеШателье, растворимость газов уменьшается. Это уменьшение тем заметнее, чем выше растворимость газов: такие газы имеют и бльшую теплоту растворения. «Мягкий» вкус кипяченой или дистиллированной воды объясняется отсутствием в ней воздуха, поскольку его растворимость при высокой температуре весьма мала.С ростом давления растворимость газов увеличивается. Согласно закону Генри (1803), масса газа, который может раствориться в данном объеме жидкости при постоянной температуре, пропорциональна его давлению. Это свойство используется для приготовления газированных напитков. Углекислый газ растворяют в жидкости при давлении 3–4 атм.; в этих условиях в данном объеме может раствориться в 3–4 раза больше газа (по массе), чем при 1 атм. Когда емкость с такой жидкостью открывают, давление в ней падает, и часть растворенного газа выделяется в виде пузырьков. Аналогичный эффект наблюдается при открывании бутылки шампанского или выходе на поверхность подземных вод, насыщенных на большой глубине углекислым газом.При растворении в одной жидкости смеси газов растворимость каждого из них остается такой же, как и в отсутствие других компонентов при таком же давлении, как в случае смеси (закон Дальтона).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Жидкости. Взаимная растворимость двух жидкостей определяется тем, насколько сходно строение их молекул («подобное растворяется в подобном»). Для неполярных жидкостей, например углеводородов, характерны слабые межмолекулярные взаимодействия, поэтому молекулы одной жидкости легко проникают между молекулами другой, т.е. жидкости хорошо смешиваются. Напротив, полярные и неполярные жидкости, например вода и углеводороды, смешиваются друг с другом плохо. Каждой молекуле воды нужно сначала вырваться из окружения других таких же молекул, сильно притягивающими ее к себе, и проникнуть между молекулами углеводорода, притягивающими ее слабо. И наоборот, молекулы углеводорода, чтобы раствориться в воде, должны протиснуться между молекулами воды, преодолевая их сильное взаимное притяжение, а для этого нужна энергия. При повышении температуры кинетическая энергия молекул возрастает, межмолекулярное взаимодействие ослабевает и растворимость воды и углеводородов увеличивается. При значительном повышении температуры можно добиться их полной взаимной растворимости.Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
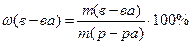 ω – массовая процентная концентрация
ω – массовая процентная концентрация
m(в-ва) – масса растворённого вещества
m(р-ра) – масса раствора
m(р-ра) = m(в-ва)+ m(р-ля) m(р-ля) – масса растворителя
Таким образом, формула для вычисления массовой процентной концентрации может быть записана так: 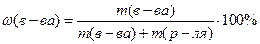
Разбавленные растворы– это растворы, концентрация которых значительно меньше концентрации насыщенного раствора данного вещества.
Концентрированные растворы – это растворы, концентрация которых близка к концентрации насыщенного раствора данного вещества.
От концентрации раствора зависит, можно ли будет употреблять в пищу какой-то продукт, от концентрации сахара, соли, уксусной кислоты и других консервантов зависит срок хранения продуктов. Например, сахар является консервантом в концентрации более 50%. Жёсткость воды зависит от концентрации растворённых в ней солей.
Индика́ тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, врастворе при титровании, или быстро определить pH, еН и др. параметры. Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Индикаторы обычно используют, добавляя несколько капель водного или спиртового раствора, либо немного порошка (например, смесь мурексида с хлоридом натрия) к пробе исследуемого раствора. Так, при титровании, в аликвоту исследуемого раствора добавляют индикатор, и наблюдают за изменениями цвета в точке эквивалентности.
Другой способ применения - использование полосок бумаги, пропитанных раствором индикатора или смеси индикаторов и высушенных (например, " Универсальный индикатор"). Такие полоски выпускают в самых разнообразных вариантах - с нанесенной на них цветной шкалой - эталоном цвета (в том числе для окрашенных или мутных сред), или с напечатанными числовыми значениями рН; для точного измерения в узких диапазонах рН, и для ориентировочного исследования растворов; в рулончиках, коробках и пеналах, или в виде отрывных книжечек.
Современные индикаторные полоски могут быть изготовлены с красителем - индикатором, привитым к целлюлозе или иному полимеру. Это делает их устойчивыми к вымыванию, вплоть до многократного использования.
На рисунке приведены ориентировочные данные о существовании разных цветных форм индикаторов в водных растворах.
Более точные сведения (несколько переходов, численное значение pH) см. в следующем разделе.
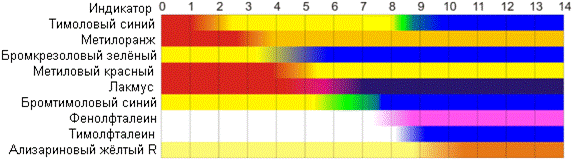
Антоцианы и другие растительные пигменты способны менять цвет в зависимости от рН среды (клеточного сока). Антоцианы имеют преимущественно красный цвет в кислой среде и синий в щелочной. Сок из красной капусты или столовой свёклы нередко используют в качестве индикатора при начальном обучении химии.
Воду с растворенными в ней солями называют жесткой, а совокупность свойств такой воды – жесткостью. Жесткая вода образует накипь на стенках паровых котлов, отопительных приборов и бытовой металлической посуды. Она не пригодна для производства бумаги и крашения тканей, для приготовления пищи и напитков. В жесткой воде не пенится мыло, плохо развариваются овощи и мясо.
Согласно ГОСТ 6055 – 86 различают:
Ø карбонатную жесткость – это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой;
Ø некарбонатную жесткость – совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой;
Ø общую жесткость, складывающуюся из карбонатной и некарбонатной жесткости. Она равна сумме концентраций ионов Са2+, Mg2+, Fе2+.
Количественно жесткость воды в России выражают единицами жесткости. За единицу жесткости принимают жесткость воды в одном литре которой содержится один миллимоль (ммоль) эквивалент ионов Са2+ или Mg2+. Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м3. Одна единица жесткости соответствует массовой концентрации ионов Са2+, равной 20, 4 мг/л или ионов Mg2+, равной 12, 15 мг/л.
По величине жесткости различают воду:
Ø очень мягкую< 1, 5 единиц (ммольэкв/л);
Ø мягкую 1, 5 – 3 единиц;
Ø среднюю 3, 6 – 6, 0 единиц
Ø жесткую 6, 0 – 9, 0 единиц
Ø очень жесткую> 9, 0 единиц.
Лениногорский район занимает первое место по количеству родников в Татарстане. По состоянию на 1 января 2006 г. на территории района насчитывается 263 родника, из них в 64 ключах постоянно контролируется качество воды. Каждый такой природный источник имеет свое название: «Лесная прохлада», «Легенда», «Петушок», «Прохладный», «Раздолье», «Старая мельница», «Муртаза» у деревни Зай-Каратай, «Тёплый ключ» у деревни Старая Письмянка, родник на базе отдыха «Ландыш», «Сернистый источник» у села Каркали и многие другие..Хозяйственно-питьевое водоснабжение г.Лениногорска, с населением около 67 тыс. человек, обеспечивается только родниковыми водами. По локальным водоводам, общей протяженностью около 35 км, родниковый сток аккумулируется на двух водонасосных станциях, далее вода поступает в накопительные резервуары водосборного пункта откуда перекачивается в городские разводящие сети.
Водосборы территории месторождения дренируются 15 родниками, из которых шесть («Салкын», «Ачи», «Тегерман -3, 4», «Куш», «Кислинка») с суммарным дебитом до 12 тыс. м3/сут, задействованы в системе централизованного водоснабжения г.Лениногорска. Родниковый сток формируется в трещиноватых известняках и песчаниках нижнеказанского подъяруса казанского яруса верхней перми.
Эксплуатация подземных вод подродниковых водоносных комплексов ограничена, вследствие широкого развития на территории Лениногорского района, битумных залежей на глубине 38 - 75 м.
Практические занятия:
- Изучение рН различных растворов с помощью универсального индикатора.
Для быстрого определения рН удобно пользоваться раствором универсального индикатора, который придает раствору окраску, зависящую от рН в пределах от 1 до 10.
При изучении раствора к 2–3 мл приливают из капельницы 1–2 капли универсального индикатора и по окраске раствора определяют рН.
| Окраска | рН |
| Малиновая | |
| Розово-оранжевая | |
| Оранжевая | |
| Желто-оранжевая | |
| Желтая | |
| Зеленовато-желтая | |
| Желто-зеленая | |
| Зеленая | |
| Сине-зеленая | |
| Серовато-синяя |
| № | Раствор | Окраска | рН |
- Свойства воды
Анализ информации «Вода как реагент и как среда для химического процесса».
ХИМИЧЕСКИЕ СВОЙСТВА
1.Вода амфотерна (свойства кислоты и основания)
Н2О = Н + + ОН -
2.Н2О + М = М (ОН)п + Н2
М-активный
3.Н2О + М2Оп = М (ОН)п (основание)
М-активный
4. Н2О + Нем2Оп= НпНемОm (кислота)
кромеSiO2
|
|
