
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 2.3. Агрегатные состояния вещества.
|
|
Основные понятия и термины по теме:
Агрегатное состояние вещества. Твёрдое тело. Газ. Жидкость. Фазовый переход. Кристаллизация. Плавление. Конденсация. Парообразование. Насыщенный пар. Ненасыщенный пар. Точка росы. Относительная влажность воздуха. Абсолютная влажность воздуха.
План изучения темы:
1 Агрегатные состояния вещества.
2. Сравнительная характеристика газов, жидкостей, твёрдых тел.
3. Фазовые переходы.
4. Влажность воздуха.
Краткое изложение теоретических вопросов:
Агрегатные состояния вещества – это состояния одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями плотности и других физических характеристик. С точки зрения МКТ агрегатные состояния вещества различаются по значению среднего расстояния между молекулами и характеру движения молекул относительно друг друга.

Твёрдое тело – это агрегатное состояние вещества, характеризующееся стабильностью формы при значительных нагрузках и тепловым движением атомов в виде малых колебаний вокруг положений равновесия. Расстояние между молекулами сравнимы с размерами самих молекул. Делятся на кристаллические тела и аморфные тела.
Аморфное тело не имеет упорядоченной структуры молекул, сохраняет форму только благодаря затруднённости перемещения молекул относительно друг друга.
Кристалл – это твёрдое тело, обладающее трёхмерной периодической атомной или молекулярной структуры.
Жидкости не образуют постоянной пространственной структуры; расположены друг от друга на расстояниях, сравнимых с размерами самих молекул. молекулы колеблются относительно определённого положения равновесия в течение времени осёдлого положения, чередующиеся со скачками в новое осёдлое положение.
Газы – молекулы хаотично и почти свободно движутся в промежутках между столкновениями, во время которых резко меняется характер их движения. Молекулы газа находятся на расстояниях, превышающих размер самих молекул в несколько раз; занимает объём любой формы.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение

Процессов, в которых происходит изменение агрегатных состояний веществ, всего шесть.
Переход вещества из твердого состояния в жидкое называется плавлением. Процесс образования кристаллов из веществ, находящихся в жидком (или аморфном) состоянии, называется кристаллизацией. Когда вещество переходит из жидкости в газ, это называется парообразованием. Конденсация – это переход вещества из газообразного состояния в жидкое. Конденсация может наблюдаться при охлаждении или сжатии газа. Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией, обратный процесс – десублимацией.
1. Плавление
2. Кристаллизация
3. Парообразование
4. Конденсация
5. Сублимация
6. Десублимация
Примеры всех этих переходов мы с вами не раз наблюдали в жизни. Лед плавится, образуя воду, вода испаряется, образуя пар. В обратную сторону пар, конденсируясь, переходит снова в воду, а вода, замерзая, становится льдом. А если вы думаете, что вы не знаете процессов сублимации и десублимации, то не спешите с выводами. Запах любого твердого тела – это и есть не что иное, как сублимация. Часть молекул вырывается из тела, образуя газ, который мы и можем унюхать. А пример обратного процесса – это узоры на стеклах зимой, когда пар в воздухе, замерзая, оседает на стекле и образует причудливые узоры.
| Наименование величины | Обозначение | Размерность | Формула |
| Количество теплоты, необходимое для нагревания | Q | Дж | Q=cmΔ t |
| Количество теплоты, необходимое для плавления и кристаллизации | Q | Дж | Q=λ m |
| Количество теплоты, необходимое для парообразования и конденсации | Q | Дж | Q=Lm |
Пар, находящийся в динамическом равновесии со своей жидкостью, называется насыщенным. Под динамическим равновесием жидкости и пара понимают такое их состояние, когда число молекул, покидающих поверхность жидкости, равно в среднем числу молекул пара, возвращающихся за то же время в жидкость. Если в замкнутом сосуде нагревается жидкость, то с ростом Т в пространстве над жидкостью растёт концентрация молекул и их средняя энергия, поэтому давление растёт нелинейно. Когда вся жидкость в сосуде превратится в пар, то давление начнёт расти прямо пропорционально температуре, как давление идеального газа.
Кипение – это процесс интенсивного парообразования, происходящей как со свободной поверхности жидкости, так и по всему объёму жидкости внутри образующихся в ней пузырьков пара. Пока вся жидкость в сосуде не выкипит, температура жидкости постоянна. Температура кипения повышается с ростом внешнего давления. Кипение происходит в случае, если давление насыщенного пара внутри пузырька пара равно или больше внешнего давления.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Влажность воздуха – физическая величина, характеризующая содержание в воздухе водяного пара.
Относительная влажность воздуха – это отношение парциального давления (или концентрации молекул) водяного пара, содержащего в воздухе при данной температуре, к давлению насыщенного пара (или его концентрации) при той же температуре:
 ,
,
 - плотность насыщенного пара при данной температуре.
- плотность насыщенного пара при данной температуре.
Относительная влажность воздуха показывает, насколько водяной пар в данных условиях близок к насыщению.
Абсолютная влажность воздуха – масса водяного пара в единице объёма газа.
Точка росы – температура, при которой находящийся в воздухе водяной пар становится насыщенным.
Лабораторные работы:
1. «Определение влажности воздуха».
Приборы и материалы: тонкостенный стеклянный или металлический стаканчик, термометр, вода, лёд, кусок ткани.
Ход работы:
Ι. Определение влажности воздуха методом «точки росы».
1. Измерить температуру комнаты
2. наполните тонкостенный стакан водой комнатной температуры и погрузите в неё термометр. Бросайте кусочки льда в воду и помешивайте её термометром, следите за наружной поверхностью стакана и температурой. В момент появления на поверхности стакана росы, запишите температуру воды в стакане. Это и есть точка росы.
3. По температуре воздуха в комнате найдите по таблице давления насыщенных паров.
4. по точке росы пользуясь таблицей, определите давления водяных паров
5. Вычислите относительную влажность воздуха по формуле:
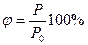
6. Вылейте из стакана холодную воду, вытрите его наружную поверхность. Налейте снова воды комнатной температуры и повторите опыт, стараясь точнее уловить момент появления росы.
7. Вычислите относительную влажность воздуха повторно и сравните результаты.
Практические занятия:
|
|
