
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аппаратура для измерения поглощения в видимом и ультрафиолетовом свете
|
|
Руководство по выполнению лабораторной работы
«Абсорбционная спектроскопия пигментов растений»
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Изучите теорию на стр. 59-76 «Практикума по общей биофизике» (Холостова, Фишов, 2002)
2 Изучите принцип работы прибора:
Аппаратура для измерения поглощения в видимом и ультрафиолетовом свете
Измерение поглощения осуществляют с помощью спектрофотометра. При описании биохимических образцов почти всегда имеются в виду растворы этих образцов. Несмотря на различия в конструкции, все спектрофотометры состоят из источника света, монохроматора (для выделения определенной длины волны), прозрачной кюветы, куда помещается образец, детектора света (как правило, состоящего из фотоэлектронного умножителя ФЭУ) и системы вывода данных (компьютер, дисплей, реже – самописец) для регистрации выходного сигнала детектора (рис. 11).

Рис. 11. Принципиальная схема устройства спектрофотометра.
Свет от лампы 1 проходит сквозь монохроматор 2 для выделения пучка света с определенной длиной волны. Монохроматичный свет проходит сквозь кювету с образцом 3 или растворителем 4, помещенные в держатель для кювет 5, затем попадает на регистрирующее устройство (ФЭУ) 6, сигнал с которого передается измерительному прибору 7.
Ход работы обычно следующий: измеряют при одной длине волны интенсивность света, прошедшего через кювету сравнения, наполненную растворителем, в котором приготовлен образец (например, буфер или вода), затем следует измерение интенсивности света, прошедшего через раствор изучаемого вещества в том же растворителе. Далее фиксируется изменение в интенсивности света, по которому можно судить о поглощении растворенного вещества. Для получения спектра эта операция повторяется при многих длинах волн. Некоторые приборы, называемые автоматическими двухлучевыми регистрирующими спектрофотометрами, позволяют осуществлять развертку длин волн и одновременно измерять поглощение образца и растворителя (которые находятся в различных кюветах) и фиксировать с помощью электронного оборудования суммированный поток излучений.
3. Экспериментальная часть
3.1 Ознакомьтесь с инструкцией по работе на спектрофотометре Genesys 10S (Thermo Scientific, США).
3.2 Регистрация спектров поглощения пигментов
Возьмите лист растения, разделите его на 3 части: 1-ая часть будет исследована в целом виде, из 2-ой части следует приготовить водный гомогенат, а из 3-ей – ацетоновый экстракт (согласно инструкции в задании 2 на стр. 84-86 «Практикума по общей биофизике»).
Зарегистрируйте спектры поглощения растительных пигментов в трех образцах:
- целом листе (расположите кусок листа вдоль прозрачной стенки кюветы)
- водном гомогенате (в кювету достаточно налить 2 мл, раствор должен быть не слишком густо окрашенный, не мутный)
- ацетоновом экстракте (в кювету следует налить 2 мл)
Условия регистрации: диапазон сканирования - 400-750 нм, шаг сканирования – 2 нм/с.
3.3 Проверка закона Бугера-Ламберта-Бера:
Измерьте спектры люминесценции пигментов в ацетоновом экстракте, разведенном в 2, 4, 8, 16 и 32 раза. Для этого заберите из кюветы 1 мл исходного экстракта и добавьте 1 мл ацетона (получили разведение ½). Перемешайте содержимое кюветы и измерьте спектр (условия аналогичные п. 3.2). Повторив данную манипуляцию еще 4 раза, получите спектры разведений ¼, 1/8, 1/16, 1/32 и 1/64.
3.4 Вычисление концентраций хлорофиллов а и б
Выберите из отснятых в предыдущем задании спектров один такой, у которого Dmax < 1. Используйте его для вычисления концентраций хлорофиллов а и б согласно формулам на стр. 87 «Практикума по общей биофизике». Исходя из полученных значений, рассчитайте концентрации хлорофиллов для всех остальных ацетоновых экстрактов.
4. Составление отчета
4.1 Предоставляемый для отчета материал
Диаграмма 1: Спектры поглощения пигментов в 3-х средах: целом листе, водном гомогенате, ацетоновом экстракте.
Диаграмма 2: Спектры поглощения пигментов в ацетоновом экстракте: исходный экстракт и все разведения.
Диаграмма 3: Зависимость максимального поглощения ацетонового экстракта от концентрации Dmax(C) (брать длинноволновый максимум).
Таблица 1: Параметры измеренных спектров поглощения:
| № | Образец | l1max, нм | D1max | l2max, нм | D2max | CХлА | СХлБ |
| Целый лист | … | … | |||||
| … | … | … | … |
4.2 Что, как минимум, следует проанализировать в отчете и вынести в выводы:
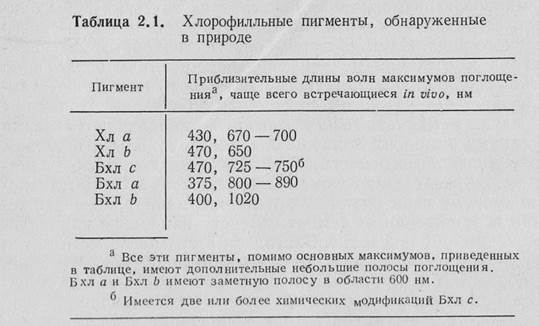
1) Спектры каких пигментов Вы наблюдали в эксперименте (воспользуйтесь Приложением 1)
2) Как смещается максимум поглощения пигментов при переходе от целого листа к водному гомогенату и ацетоновому экстракту? Почему?
3) Рассчитайте энергию возбужденного состояния (в см-1) в каждом образце.
4) Смещается ли максимум поглощения пигментов в ацетоновом экстракте при уменьшении концентрации? Если да, то почему?
5) Выполняется ли закон Бугера-Ламберта-Бера для ацетонового экстракта? Если выполняется не на всем диапазоне концентраций, то по какой причине нарушается? Какой диапазон концентраций пригоден для проведения количественного анализа?
ПРИЛОЖЕНИЕ 1
|
|