
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Соединения серебра (I); оксид, его свойства, нитраты, галогениды, их свойства. Комплексные соединения серебра, свойства и способы получения.
|
|
Оксид серебра(I) — химическое соединение с формулой Ag2O.
Оксид может быть получен взаимодействием нитрата серебра с щёлочью в водном растворе:

Это связано с тем, что образующийся в ходе реакции гидроксид серебра(I) быстро разлагается на оксид и воду:
 (p K = 2.875)
(p K = 2.875)
Более чистый оксид серебра(I) может быть получен в результате анодного окисления металлического серебра в дистиллированной воде
Ag2O практически нерастворим в большинстве известных растворителей, исключая те, с которыми он взаимодействует химически. В воде он образует незначительное число ионов Ag(OH)2− . Ион Ag+ гидролизуется очень слабо (1: 40, 000); в водном растворе аммиака разлагается с образованием растворимых производных.
Свежий осадок Ag2O легко взаимодействует с кислотами:
 ,
,
где HX = HF, HCl, HBr, HI, HO2CCF3. Также Ag2O реагирует с растворами хлоридов щелочных металлов, образуя хлорид серебра (I) и соответствующую щёлочь.
Обладает фоточувствительностью. При температуре выше 280 °C разлагается.
Нитра́ т серебра́ (I) (азотноки́ слое серебро́, «адский камень», ля́ пис) — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде..
При температуре выше 300 °C разлагается. Хорошо растворим в воде, метиловом спирте, в этиловом спирте, в ацетоне, в пиридине. Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
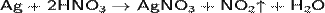
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:


При нагревании соль разлагается, выделяя металлическое серебро:

Галогениды серебра - химические соединения серебра с галогенами. Хорошо изучены галогениды одновалентного серебра: фторид — AgF, хлорид — AgCI, бромид — AgBr, иодид Agl.Известны также Ag2F и AgF2 (сильный окислитель). Кристаллы AgF бесцветны, AgCI — белые, AgBr и Agl окрашены в жёлтый цвет. Известны кристаллогидраты AgF·xH2O (где х = 1, 2, 3). AgF нельзя хранить в стеклянной посуде, т. к. разрушается стекло. Все галогениды серебра, за исключением фторидов, обладают очень малой растворимостью в воде; в присутствии соответствующих галогенводородных кислот или их солей растворимость заметно повышается за счёт образования комплексных соединений типа [AgX2]‑ , где Х — Cl, Вг, I. Все галогениды серебра растворяются в аммиаке с образованием комплексных аммиакатов. Этим пользуются для очистки галогенидов серебра и их перекристаллизации. В твёрдом состоянии галогениды серебра присоединяют газообразный аммиак, образуя комплексные соединения AgX·NH3, AgX·ЗNH3. Галогениды серебра легко восстанавливаются до металлического серебра под действием Zn, Mg, Hg, щелочных металлов, H2. Галогениды AgCI и AgBr могут быть восстановлены металласплавлением с Na2CO3. Получают галогениды серебра непосредственным взаимодействием галогенов и серебра при высокой температуре. Трудно растворимые галогениды серебра могут быть получены также осаждением из раствора AgNO3 при помощи соответствующих галогенводородных кислот или их солей (растворимых), а AgF — привзаимодействии Ag2O или Ag2CO2 с HF.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Соединения золота (I), свойства и способы получения. Соединения золота (III), оксид и гидроксид, галогениды, способы получения, комплексные соединения. Применение простых веществ и соединений.
Соединения Au(I) -твердые кристаллические солеподобные вещества, в большинстве нерастворимые в воде.
Производные Au(I) образуются при восстановлении соединений Au(III). Большинство соединений Au(I) легко окисляются, переходя в устойчивые производные Au(III).
3AuCl(крист) + KCl(p-p) = K[AuCl4](p-p) + 2Au
Известны: оксид золота(I) Au2O*xH2O фиолетовый, хлорид золота(I) AuCl желтый, получают разложением AuCl3.
Более устойчивы комплексные соединения, например цианидные K[Au(CN)2], или тиосульфатные K3[Au(S2O3)2].
Окси́ д зо́ лота(III) — бинарное неорганическое химическое соединение золота и кислорода с формулой Au2O3. Наиболее устойчивый оксид золота.
Получается из гидроксида золота(III) Au2O3 x H2O обезвоживанием при нагревании. Полная потеря воды наступает при температуре около 200о С.. Полученный таким образом оксид золота(III) аморфен. Имеет красный или красно-бурый цвет. Примесь бурого, как и в случае гидроксида золота(III), обычно связывают с присутствием небольшого количества золота(0). Монокристаллы Au2O3 были получены из аморфного оксида гидротермальным синтезом в кварцевой ампуле, заполненной на треть смесью хлорной кислоты HClO4 и перхлората щелочного металла (температура синтеза 235—275о С, давление до 30 МПа). Полученные монокристаллы имели рубиново-красный цвет.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Дигидра́ т окси́ да зо́ лота(III) («золотая кислота») — Au2O3•2H2O, неорганическое комплексное соединение золота, производное оксида золота(III), ранее неверно называемое гидроксид золота(III) или гидроокись золота(III) с приписываемой ему условной формулой Au(OH)3.
Если к раствору хлорида золота(III) добавить гидроксид щелочного или щёлочноземельного металла или кипятить его после добавления щелочного карбоната, то выделится осадок гидроксида золота(III), однако обычно сильно загрязнённой примесью осадителя. При подходящих условиях загрязнение удаётся устранить путём экстрагирования кислотами.
В результате высушивания над пятиокисью фосфора получается жёлто-красный или жёлто-коричневый порошок состава AuO(OH). Он растворяется в соляной кислоте и в других кислотах, если они достаточно концентрированные, а также в горячем едком кали, откуда следует, что амфотерен. Так как кислотный характер преобладает, то гидроксид золота(III) называют обычно золотой кислотой. Соли этой кислоты называются ауратами, например K[AuO2]·3·H2O —аурат(III) калия. Дигидрат оксида золота (III) легко распадается на оксид золота и воду.
Галогениды, оксиды и гидроксид Au(III)-амфотерные соединения с преобладанием кислотных признаков. Так Au(OH)3 легко растворяется в щелочах, образуя гидроксоаураты (III):
NaOH + Au(OH)3 = Na [Au(OH)4]
Даже растворение в кислотах Au(OH)3 происходит за счет образования анионных комплексов:
Au(OH)3 + 4 HNO3 = H[Au(NO3)4] + 3 H2O
В присутствии солей щелочных металлов образуются аураты:
M[Au(NO3)4] нитрато-
M [Au(SO4)2]сульфато-
M[Au(CN)4]циано-
M[AuS2] сульфидо-
Кислотный характер галогенидов Au(III)проявляется в их исключительной склонности давать галогеноаураты (III) M[AuHal4].Большинство галогеноауратов хорошо растворимо в воде и органических растворителях.
Особая склонность Au(III) к образованию анионных комплексов проявляется и при гидролизе его тригалогенидов:
AuCl3+H2O== H[Au(OH)Cl3]
AuCl3+H2O== H2[AuOCl3]
Образующаяся при этом кислота H2[AuOCl3] дает трудно растворимую соль Ag2[AuOCl3].
Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия.
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза, ревматоидных артритов и т. д.). Радиоактивное золото используют при лечении злокачественных опухолей.
72. Общая характеристика d-элементов II группы, получение и свойства. Оксиды, гидроксиды, соли – свойства, получение. Применение простых веществ и соединений.
Щёлочноземе́ льные мета́ ллы — химические элементы 2-й групп периодической таблицы элементов: бериллий, магний, кальций, стронций, барий, радий и унбинилий.
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств.
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ = 5, 5 г/см3).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам и кальцию, хранят под слоем керосина.
Также, в отличие от щелочных металлов, щелочноземельные металлы не образуют надпероксиды и озониды.
|
|
