
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Семейство железа. Общая характеристика элементов; нахождение в природе, способы получения. Чугун и сталь. Оксиды, гидроксиды и соли элементов (II), их свойства и получение.
|
|
Семейство железа входит в состав побочной подгруппы восьмой группы и является в ней первой триадой, включающей в себя железо, кобальт и никель, обладающие схожими физическими свойствами, атомными радиусами и значениями электро-отрицательности.
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Железо один из самых распространённых в земной коре металлов (второе место после алюминия).
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4, 65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́ льшую часть земного ядра.
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс. Кроме того распространён процесс прямого получения железа.
Химически чистое железо получается электролизом растворов его солей.
Кобальт Co — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом.
Массовая доля кобальта в земной коре 4·10− 3%. Кобальт входит в состав минералов: каролитCuCo2S4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтин CoAs2, скуттерудит(Co, Ni)As3 и других. Всего известно около 30 кобальтосодержащих минералов. Содержание в морской воде приблизительно (1, 7)·10− 10%.
Кобальт получают в основном из никелевых руд, обрабатывая их растворами серной кислоты или аммиака. Также используется методы пирометаллургии. Для отделения от близкого по свойствам никеля используется хлор, хлорат кобальта (Co(ClO3)2) выпадает в осадок, а соединения никеля остаются в растворе.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Никель — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.
Никель довольно распространён в природе — его содержание в земной коре составляет около 0, 01 % (масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8 %).
В растениях в среднем 5·10− 5 весовых процентов никеля, в морских животных — 1, 6·10− 4, в наземных — 1·10− 6, в человеческом организме — 1…2·10− 6.
Основную массу никеля получают из гарниерита и магнитного колчедана.
1. Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8 % Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
2. Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
3. Алюминотермический способ восстановления никеля из оксидной руды:
3NiO + 2Al = 3Ni +Al2O3
Чугу́ н — сплав железа с углеродом (и другими элементами). Содержание углерода в чугуне не менее 2, 14%: меньше — сталь. Углерод придаёт сплавам железа твёрдость, снижая пластичность и вязкость. Углерод в чугуне может содержаться в виде цементита и графита. В зависимости от формы графита и количества цементита, выделяют белый, серый, ковкий и высокопрочный чугуны. Чугуны содержат постоянные примеси (Si, Mn, S, P), а в некоторых случаях также легирующие элементы (Cr, Ni, V, Al и др.). Как правило, чугун очень тверд.
Сталь — сплав железа с углеродом (и другими элементами). Содержание углерода в стали от 0, 1 до 2, 14 %. Углерод придаёт сплавам железа прочность и твёрдость, снижая пластичность и вязкость.
Учитывая, что в сталь могут быть добавлены легирующие элементы, сталью называется содержащий не менее 45 % железа сплав железа с углеродом и легирующими элементами (легированная, высоколегированная сталь).
Суть процесса переработки чугуна на сталь состоит в уменьшении до нужной концентрации содержания углерода и вредных примесей — фосфора и серы, которые делают сталь хрупкой и ломкой. В зависимости от способа окисления углерода существуют различные способы переработки чугуна на сталь: конверторный, мартеновский и электротермический.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Оксид железа (II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Соли железа (II) обладают светло-зелёным цветом. При их хранении, особенно во влажном воздухе, они коричневеют за счёт окисления до железа (III). Такой же процесс протекает при хранении водных растворов солей железа(II):

Из солей железа (II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Гидрокси́ д желе́ за(II) — неорганическое вещество с формулой Fe(OH)2, соединение железа.Амфотерный гидроксид с преобладанием осно́ вных свойств. Кристаллическое вещество белого (иногда с зеленоватым оттенком) цвета, на воздухе со временем темнеет. Является одним из промежуточных соединений при ржавлении железа.
Гидроксид железа(II) может быть получен в виде осадка в обменных реакциях растворов солей железа(II) со щёлочью, например:
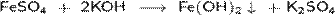
Образование гидроксида железа(II) является одной из стадий ржавления железа:

Оксид кобальта(II) — неорганическое соединение, оксид металла кобальта с формулой CoO, тёмно-зелёные (почти чёрные) кристаллы, не растворимые в воде.
Получение.
· Окисление кобальта на воздухе:

· Разложение оксида кобальта(II, III) при нагревании:

· Разложение гидроксида кобальта(II) в вакууме:

· Разложение сульфата кобальта(II):

· Окисление октакарбониладикобальта:

Химические свойства.
· Растворяется в разбавленных кислотах:

· Медленно растворяется в горячих щелочах:

· Окисляется кислородом воздуха при нагревании:

Гидроксид кобальта(II) — неорганическое соединение, гидроокись металла кобальта с формулой Co(OH)2, в зависимости от способа получения имеет окраску розовую, синюю, фиолетовую, не растворяется в воде, образует гидраты.
Получаютдействием разбавленных щелочей на раствор солей двухвалентного кобальта:


Химические свойства.
· Реагирует с кислотами:

· Медленно реагирует с щелочами:

· Окисляется кислородом под давлением:

· Окисляется горячей перекисью водорода::

Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
Оксид никеля(II) — неорганическое бинарное соединение двухвалентного никеля с кислородом. Химическая формула NiO. Встречается в природе в виде редкого минерала бунзенита.
Оксид никеля(II) — кристаллическое вещество, в зависимости от способа получения и термической обработки имеет цвет от светло- до тёмно-зелённого или чёрного.
Оксид никеля можно синтезировать непосредственно из элементов окислением Ni при нагревании на воздухе или в кислороде:

Оксид никеля(II) может быть получен термическим разложением в гидроксида никеля(II) или некоторых солей двухвалентного никеля (карбоната, нитрата и др.):


Химические свойства.
· Реагирует с кислотами:

· При спекании взаимодействует с щелочами и оксидами типичных металлов:

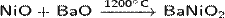
· При сплавлении с кислотными оксидами образует соли:

Гидроксид никеля(II) — неорганическое соединение, гидроокись металла никеля с формулой Ni(OH)2, светло-зелёные кристаллы, не растворяется в воде, образует гидраты.
Получают действием концентрированных щелочей на раствор солей двухвалентного никеля:


Химические свойства.
· При нагревании разлагается:

· Реагирует с кислотами:

· Является слабым восстановителем:

Важнейшие растворимые соли никеля — ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли — жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида: NiS (черный), Ni3S2 (желтовато-бронзовый) и Ni3S4 (серебристо-белый).
Оксиды, гидроксиды и соли железа(III), кобальта (III), никеля (III),, способы получения и свойства. Соединения железа (VI), ферраты, их свойства. Применение металлов и их соединений.
Окси́ д желе́ за(III) — сложное неорганическое вещество, соединение железа и кислорода с химической формулой Fe2O3.
Получение.
Термическое разложение соединений солей железа(III) на воздухе:
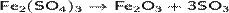

Обезвоживание метагидроксида железа прокаливанием:

В природе — оксидные руды железа гематит Fe2O3 и лимонит Fe2O3· n H2O
Химические свойства.
1. Взаимодействие с разбавленной соляной кислотой:

2. Взаимодействие с карбонатом натрия:

3. Взаимодействие с гидроксидом натрия при сплавлении:

4. Восстановление до железа водородом:

Гидроксид железа(III) — неорганическое соединение, гидроксид металла железа с формулой Fe(OH)3, красновато-коричневые кристаллы, не растворяется в воде. Проявляет слабые амфотерные свойства с преобладанием основных.
Получение.
· В природе встречается минерал лимнит (разновидность лимонита), по составу совпадает с Fe(OH)3.
· Действие щелочей на растворимые соли железа(III):

Химические свойства.
· При частичной дегидратации разлагается до железистой кислоты (или метагидроксида железа):

· Разлагается при нагревании:
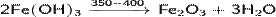
· Реагирует с кислотами:

· и щелочами:

Соли Fe3+ склонны к образованию кристаллогидратов. В них ион Fe3+, как правило, окружен шестью молекулами воды. Такие соли имеют розовый или фиолетовый цвет.
Оксид кобальта(III) — неорганическое соединение, оксид металла кобальта с формулой Co2O3, чёрные кристаллы, не растворимые в воде.
Получение.
· Разложение гидроксида кобальта(III) при нагревании:

· Разложение нитрата кобальта(II) при нагревании:

Химические свойства.
· Ступенчато разлагается при нагревании:

· Окисляет соляную кислоту:

Гидроксид кобальта(III) — неорганическое соединение, гидроксид кобальта с формулой Co(OH)3 (или CoOOH•H2O), темно-коричневое вещество, не растворяется в воде.
Получаютдействием окислителей на соли кобальта(II) в щелочной среде:

Химические свойства.
· С трудом реагирует с кислотами:
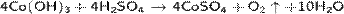

· Разлагается при нагревании:

Растворы солей кобальта CoSO4, CoCl2, Со(NO3)2 придают воде бледно-розовую окраску. Растворы солей кобальта в спиртах темно-синие. Многие соли кобальта нерастворимы.
Оксид никеля(III) — бинарное неорганическое соединение металла никеля и кислорода с формулой Ni2O3, тёмно-серый порошок, не растворяется в воде, образует гидраты.
Получаютосторожным нагреванием нитрата или хлората никеля.
Химические свойства.
· Разлагается при нагревании до оксида никеля(II, III):

Гидроксид никеля (III) Ni (OH)3 получается в виде черно-бурого осадка при действии окислителей на гидроксид никеля (II).
Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи[26]:

Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде:

Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода
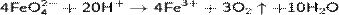
Окислительные свойства ферратов используют для обеззараживания воды.
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Применение кобальта.
· Легирование кобальтом стали повышает её жаропрочность, улучшает механические свойства. Из сплавов с применением кобальта создают обрабатывающий инструмент: свёрла, резцы, и т. п.
· Магнитные свойства сплавов кобальта находят применение в аппаратуре магнитной записи, а также сердечниках электромоторов и трансформаторов.
· Для изготовления постоянных магнитов иногда применяется сплав, содержащий около 50 % кобальта, а также ванадий или хром.
· Кобальт применяется как катализатор химических реакций.
· Кобальтат лития применяется в качестве высокоэффективного положительного электрода для производства литиевых аккумуляторов.
Основная масса никеля в промышленности расходуется на производство сплавов для электротехники: инвара, платинита, нихрома, никелина. Никелевые сплавы применяют также в химической и авиационной промышленности в судостроении. Как легирующий металл никель сообщает сталям вязкость, механическую прочность, жаростойкость, устойчивость к коррозии. Хромоникелевые стали идут на изготовление брони, бронебойных снарядов, артиллерийских орудий. Никель используют в щелочных аккумуляторах.
Платиновые металлы. Общая характеристика элементов. Нахождение в природе. Понятие о разделении элементов, гидроксиды платины (II), (IV), их свойства. Оксиды рутения и осмия (VIII).
Металлы платиновой группы — коллективное обозначение шести переходныхметаллических элементов (рутений, родий, палладий, осмий, иридий, платина), имеющих схожие физические и химические свойства, и, как правило, встречающихся в одних и тех же месторождениях. Металлы платиновой группы являются благородными и драгоценными металлами. Иногда, металлы платиновой группы подразделяют на две триады: рутений, родий и палладий — лёгкие платиновые металлы, а платина, иридий и осмий — тяжёлые платиновые металлы.
Все платиновые металлы светло-серые и тугоплавкие, платина и палладий пластичны, осмий и рутений хрупкие. Красивый внешний вид благородных металлов обусловлен их инертностью.
Платиновые металлы обладают высокой каталитической активностью в реакциях гидрирования, что обусловлено высокой растворимостью в них водорода.
Все платиновые металлы химически инертны. Многие из них в твёрдом виде не растворяются даже в царской водке. В мелкодисперсном виде или в виде губки, царская водка слабо растворяет рутений, и совсем незначительно родий и иридий. Платина и палладий, более реакционноспособны, палладий растворяется в азотной кислоте, а платина, не так инертна, как принято считать, и растворяется даже в соляной кислоте, в присутствии воздуха. Реакции растворения в царской водке идут с образованием хлоридных комплексов:
При окислении металлов кислородом воздуха образуются оксиды различного состава:
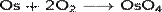



При нагревании все платиновые металлы реагируют с хлором и фтором:
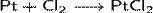


Платина и металлы её группы встречаются в природе в весьма рассеянном состоянии. Известно около ста минералов платиновой группы. Минералы платиноидов распространены как в самородной форме, так и в виде твёрдых растворов и интерметаллических соединений с Fe, Ni, Cu, Sn, реже Au, Os, Pb, Zn, Ag. Наиболее распространёнными являются поликсен (Pt, Fe), ферроплатина (Pt, Fe), палладистая платина (Pt, Pd), станнопалладинит Pd3Sn2Cu, гиверсит PtSb2, звягинцевит (Pd, Pt)3(Pb, Sn).
Осмий, рутений и родий образуют твёрдые растворы. К ним относятся такие минералы как иридий (Ir, Os), осмий (Os, Ir).
Выделение, разделение и очистка (аффинаж) платиновых металлов представляет собой одну из сложнейших задач препаративной неорганической химии. Исходные руды подвергают обогащению, и из полученных концентратов выплавляют медь и никель. При электролитическом рафинировании никеля в анодных шламах концентрируются платиновые металлы, а при рафинировании меди, кроме того, – серебро и золото. Шламы растворяют в царской водке. При этом все платиновые металлы, кроме осмия, переходят в раствор в виде комплексных кислот H 2[Э Cl 6 ], а осмий остается в осадке в виде OsO4. Далее платину осаждают хлоридом аммония в виде(NH 4)2[ PtCl 6] и затем последовательно выделяют остальные платиновые металлы в виде соединений (NH 4)2[Э Cl 6]. Из маточного раствора упариванием в присутствии HNO 3 выделяют хлороиридат (NH 4)2[ IrCl 6]. После осаждения платины и иридия из раствора, подкисленного серной кислотой, выделяют палладий, рутений и родий в виде металлов путем восстановления цинком. При этом выделяются и остатки платины и иридия. На смесь порошкообразных металлов действуют царской водкой. Родий и рутений остаются в осадке в виде черни(тонкодисперсный порошок). Оставшийся в растворе палладий осаждают в виде нейтрального комплекса [ Pd (NH 3)2 Cl 2]. Родий из черни выделяют растворением в серной кислоте с последующим осаждением, например, в виде [ Rh (NH 3)6] Cl 3, а рутений отгоняют в виде летучего RuO 4 c последующим восстановлением. Платиновые металлы высокой степени чистоты получают многократным повторением операций перевода их в раствор, осаждения и разложения соответствующих соединений.
Гидроксид платины(II) — неорганическое соединение, гидроокись металла платины с формулой Pt(OH)2, чёрные кристаллы, не растворяется в воде, образует гидраты.
Получают действием щелочи на тетрахлороплатинат(II) калия:

Реагирует с соляной кислотой:
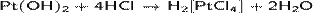
Окисляется озоном:

Гидроксид платины(IV) — неорганическое соединение, гидроокись металла платины с формулой Pt(OH)4, красно-бурые кристаллы, не растворяется в воде.
Получают гидролизом гексахлороплатината(IV) натрия:

При нагревании до 110°С начинает терять воду.
Реагирует с кислотами:

Реагирует с избытком щелочей:

Оксид рутения(VIII) — неорганическое соединение, оксид металла рутения с формулой RuO4, жёлто-оранжевые кристаллы, умеренно растворимые в воде, образует гидраты.
Получение.
· Окисление кислородом воздуха рутения при нагревании:

· Окисление рутения броматом калия:

· Разложение оксида рутения(IV) при нагревании:

· Окисление оксида рутения(IV) кислородом:

· Окисление тетраоксорутената(VI) калия хлором:
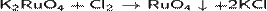
При нагревании выше 100°С разлагается со взрывом.
Сильный окислитель, пахнет озоном, со спиртом реагирует со взрывом.
Умерено растворяется в воде, водные растворы являются слабой кислотой p K1 = 11, 0.
Окси́ д о́ смия(VIII) (тетраокси́ д о́ смия) — высший оксид осмия, брутто-формула (система Хилла) OsO4.
Получают взаимодействием металлического осмия с кислородом при высокой температуре:

Оксид осмия (VIII) при стандартных условиях представляет собой жёлто-коричневые кристаллы моноклинной формы с характерным запахом, напоминающим озон. Неустойчив, возгоняется уже при комнатной температуре. Оксид осмия (VIII) хорошо растворим в различных органических растворителях, умеренно растворим в воде, с которой он обратимо реагирует с образованием [Os(H2O)2O4].
|
|
