
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приведенные характеристики топлива.
|
|
Для сравнения экономичности котлов сжигающих различное топливо введено условное топливо.
Qрн.(усл.) = 29, 3 

Для оценки массовых расходов влаги, золы и серы существуют приведенные характеристики:
1. 
Если Wп < 0.75, то топливо маловлажное, если же Wп > 2 – высоковлажное.
2. 
Если Ап < 1, то топливо малозольное, а если Ап > 4 – высокозольное.
3. 
Если Sп > 0, 05 – мазут высокосернистый, если Sп > 0.2 – высокосернистый уголь.
Изменение характеристик топлива:
| Топливо | Сг, % | Oг, % | Нг, % | Vг, % | Qнв, % |
| Дерево |  50 50
|  43 43
|  6 6
 2 2
|  85 85
|  10 10
 23 23
|
| Торф | |||||
| Б.У. | |||||
| К.У. | |||||
| Ант. |
Газовое топливо.
Состав:
СН4 + ∑ СmHn + CO + H2S + H2 + CO2 + N2 + SO2 + O2 = 100%
СН4 + ∑ СmHn + CO + H2S + H2 – горючие вещества,
CO2 + N2 + SO2 + O2 – негорючие вещества.
Qнв = 0, 01 . (СН4 . QСН4 + ∑ СmHn . Q∑ СmHn + CO . Q CO + H2S . Q H2S + H2 . QН2), 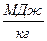
Природный газ.
Имеет органическое происхождение. Природный газ образовался в полостях земли при давлении более 200 атм.
Месторождения:
1. Тюменская область;
2. Республика Коми;
3. Южный Урал;
4. Ставрополье.
Состав:
СН4 + ∑ СmHn + CO2 + N2 = 100%.
СН4 = 70-99%, ∑ СmHn = 1-10%, CO2 < 2%, N2 < 14%.
Особенности:
1. Отсутствие внешнего балласта (влажность и зольность),
2. мало внутреннего балласта (содержание азота менее 14%, а кислорода равно 0%),
3. содержание серы равно 0%,
4. высокая удельная теплота сгорания (Qсн. = 34-38,  ),
),
5. плотность ρ г = 0, 7-0, 9,  ,
,
6. 


 взрываемость
взрываемость
не горит взрыв горит
 Сниз Сверх
Сниз Сверх  , %
, %
7. токсичность за счет CO, H2S
ПДКCO = 0, 024%(предельная допустимая концентрация),
ПДКH2S = 0, 01%.
8. нет цвета и запаха.
Для обнаружения природного газа в него вводят одерант в количестве 10 г на 1000 м3 газа.
Попутный газ.
Образуется при добыче нефти, при резком снижении давления.
Состав:
СН4 = 40-60%, ∑ СmHn = 25-35%, N2 = 20%.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Qсн. = 36-46 
Подземный (генераторный) газ.

 Воздух (О2 = 21%) генераторный газ + О2
Воздух (О2 = 21%) генераторный газ + О2
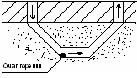 порода
порода
угольный пласт
Во входном штреке происходит окисление С и Н:
С + О2 = СО2
Н2 + О2 = Н2О
В выходном же штреке протекают восстановительные реакции:
СО2 + С = СО
Н2О + С = СО + Н2
Состав:
СО = 15%, Н2 = 15%, СО2 = 10%, N2 = 60%.
Qсн. = 4 
Доменный газ.
 |

 воздух
воздух
 зона активного горения С + О2 = СО2
зона активного горения С + О2 = СО2
Состав:
СО = 30%, Н2 = 1%, СО2 = 10%, N2 = 60%.
Qсн. = 4 
Коксовый газ.
Получается при производстве кокса при t = 500 - 1000º С.
Состав:
СН4 = 25%, Н2 = 45%, N2 = 5%.
Qсн. = 38 
Жидкое топливо.
Природное топливо – нефть, имеющая органическое происхождение, представляет собой смесь жидких углеводородов. Добывается через скважины за счет собственного давления.
Месторождения:
- Тюменская область;
- Республика Коми;
- Башкирия;
- Татарстан;
- Северный Кавказ.
Мазут – остаток нефтепереработки на нефтеперерабатывающем заводе = 25-40%.
tкип = 200 – 250 – 300 – 350, º С
бензин керосин дизельное топливо мазут
Состав мазута:
Ср = 84%, Нр = 11%, Sр = 0, 3-3%, (N + O2)р = 0, 5%, Wр = 3%, Aр = 0, 1%.
Qрн. = 40  .
.
Марки мазута:
- Флотские Ф5, Ф12;
- топочные М40, М100;
- мартеновских печей МП.
Если Sр < 0.5%, то мазут малосернистый;
Если Sр = 0, 5-2%, то сернистый;
Если Sр > 2%, то высокосернистый.
Температурные характеристики:
1. Вязкость. Она влияет на продолжительность слива, на эффективность перекачивания насосами и на качество распыления форсунками.
Условная вязкость:
ВУt =  , º УВ. С ростом температуры вязкость снижается.
, º УВ. С ростом температуры вязкость снижается.
2. Температура застывания – температура, при которой мазут теряет свою текучесть.
Испытания на текучесть происходят так:
в пробирку наливают мазут; охлаждают до определенной температуры; затем пробирку наклоняют (45º), если в течение минуты уровень жидкости в пробирке не стал параллелен горизонту, то мазут застыл.
tзаст. = 10-40º С
3. Температура вспышки – температура мазута, при которой его пары образуют горючую смесь, вспыхивающую при поднесении пламени.
tвсп = 90-140º С
4. Температура воспламенения – температура мазута, при которой пары воспламеняются и горят более 5 секунд.
tвосп = tвсп + 15º С
5. Плотность ρ маз = 0, 96 – 1, 05 
При эксплуатации влажность возрастает до 6 –15%, возникает эффект обводнения. В результате обводнения:
а) снижается Qрн (так как снижается концентрация горючих элементов), а значит растет расход топлива В;
б) снижается температура пламени в топке, поэтому снижается паропоизводительность котла;
в)растет объем водяных паров VH2O, а значит растет температура уходящих газов, поэтому снижается КПД котла.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
6. Зольность мазута очень мала Aр < 0, 1%, но она на 50% состоит из пятиокиси ванадия V2O5(tпл = 700º С). Она разрушает защитную окислительную пленку на поверхностях нагрева, открывая доступ кислорода к металлу, и начинается процесс ванадиевой коррозии.

|
Fe


 пар
пар


 О2 V2O5
О2 V2O5
 |
Топочные процессы.
С, Н, S – горючие элементы.
Горение – химический процесс окисления горючих элементов кислородом,
протекающий при высокой температуре, с высокой скоростью о сопровождающийся значительным выделением теплоты.
С + О2 = > СО2 + Qc↑
2Н2 + О2 = > 2Н2О + QH2↑
S + О2 = > SO2 + QS2↑
  Горение Горение
| |
| полное (образуются продукты СО2, Н2О, SO2) | неполное (дополнительно образуются СО, Н2, СН4) |
Причины неполноты горения:
- локальный недостаток окислителя:
С + 0, 5О2 = > СО - температура газов < 1000º С, либо > 2000º С;
- недостаточный контакт горючих элементов и окислителя.
Расчет процессов горения твердого (жидкого) топлива.
Топливо: С + Н + S + O + N + W + A = 100%
Топочные газы: (СО2 + Н2О + SO2) + (СО + Н2 + СН4) + N2 + O2изб = 100%
Воздух: О2 + N2 = 100%
Элементарные реакции горения:
- горение С
С + О2 = > СО2 МО2С = 2, 67
12 32 44
1кг 2, 67кг 3, 67кг
- горение Н
2Н2 + О2 = > 2Н2О МО2Н = 8 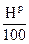
4 32 36
1кг 8кг 9кг
- горение S
S + О2 = > SO2 МО2S =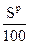
32 32 64
1кг 1кг 2кг
Теоретический расход О2:
МО2 = МО2С + МО2Н + МО2S – МО2топл = 2, 67  + 8
+ 8 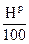 +
+ 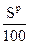 –
–  ,
, 
Теоретический объем воздуха – это то количество воздуха, которое необходимо израсходовать для полного сжигания 1 кг топлива, при условии, что весь кислород прореагировал с горючими.

С увеличением балласта Vº снижается
Vº = 3 – 6 – 10, 
Б.У. Антр. Мазут
|
|
