
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина. 1. Калій перманганат як окисник в різних середовищах (як відновник можна застосувати розчини Na2SO3
|
|
1. Калій перманганат як окисник в різних середовищах (як відновник можна застосувати розчини Na2SO3, FeSO4, KNO2). В три пробірки налити 2-3 мл розведеного розчину KMnO4.
а) до розчину в першій пробірці додати 1 мл розчину H2SO4 і по краплях розчин Na2SO3 до знебарвлення. Напишіть рівняння реакції і підберіть коефіцієнти методом електронного балансу, якщо відомо, що в кислому середовищі йон MnO4- переходить в йон Mn2+, а йон SO32- в йон SO42-;
б) до другої порції розчину KMnO4 додати 1 мл дистильованої води і по краплях розчин Na2SO3 до появи бурого осаду MnO(OH)2. Підберіть коефіцієнти в рівнянні даної реакції:
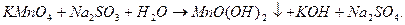
в) в останню порцію розчину KMnO4 додати 1 мл розчину NaOH і по краплях розчин Na2SO3 до появи зеленого забарвлення розчину.
Напишіть та урівняйте рівняння реакції, якщо в лужному середовищі йон MnO4- переходить в йон MnO42-, а йон SO32- в йон SO42-:

2. Гідроген пероксид як окисник.
До 2 мл розчину КІ додати 1 мл розчину H2SO4 і по краплях розчину Н2О2. Записати спостереження. Дописати і урівняти рівняння реакції:

3. Гідроген пероксид як відновник.
До 2-3 мл розчину KMnO4 додати 1 мл H2SO4 та по краплях розчин Н2О2 до знебарвлення. Закінчити рівняння:

4. Відновлення калій дихромату калій йодидом.
До 2-3 мл розчину K2Cr2O7 додають 1 мл розчину H2SO4 та по краплях розчин КІ до зміни забарвлення розчину.
Записати спостереження та урівняти рівняння реакції:

Визначити яка речовина є окисником, а яка – відновником.
5. Розклад амоній дихромату.
На азбестову сітку містять купкою 1-2 г кристалічного (NH4)2Cr2O7 й обережно нагрівають невеликим полум’ям до початку реакції. Записати спостереження та скласти рівняння реакції, враховуючи, що продуктами реакції є хром(ІІІ) оксид, азот та вода.
Контрольні завдання
1. Визначити до якого типу відноситься кожна з реакцій, виражена наступними схемами:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
а) N2O5 → NO2 + O2;
б) H2S + H2SO3 → S + H2O;
в) SO32- + O2 → SO42 -.
2. Виходячи зі ступеня окиснення Нітрогену, Сульфуру і Мангану в сполуках NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2, KMnO4 визначте, які з них можуть бути тільки відновниками і тільки окисниками, які виявляють як окисні, так і відновні властивості.
3. Чи можуть відбуватися окисно-відновні реакції між такими речовинами: а) H2S і НІ; б) H2S і H2SO3; в) H2SO3 і HClO4?
4. Складіть рівняння окисно-відновної реакції, що проходить за схемою:

5. Реакції виражаються схемами:

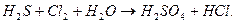
Складіть електронні рівняння. Розставте коефіцієнти в рівняннях реакцій. Для кожної реакції визначте, яка речовина є окисником, яка – відновником, яка речовина окиснюється, яка – відновлюється.
|
|
