
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция 10. Электронные состояния и электронно-колебательно-вращательные спектры молекул (УФ)
|
|
Электронные состояния и электронно-колебательно-вращательные спектры молекул (УФ). Спектры двухатомных молекул. Классификация электронных состояний и разрешенные переходы. Колебательная структура. Таблица и серии Деландра. Принцип Франка-Кондона. Определение энергии диссоциации. Вращательная структура.
Классификация электронных состояний двухатомных молекул по проекции орбитального момента количества движения.
Эта классификация основана на следующем.
Орбитальный момент. Квадрат суммарного вектора L момента количества движения всех электронов молекулы определяется выражением:
L2 = 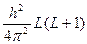
где L – соответствующее квантовое число.
Каждое электронное состояние двухатомной молекулы характеризуется определенным значением проекции орбитального момента количества движения на линию, соединяющую ядра молекулы. Эта проекция выражается в виде:
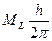
где 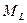 - квантовое число проекции орбитального момента – может быть равно одному из чисел:
- квантовое число проекции орбитального момента – может быть равно одному из чисел: 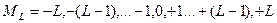
Состояния, отличающиеся только знаком 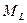 , не различаются по энергии. Различия в энергии определяются числом
, не различаются по энергии. Различия в энергии определяются числом 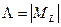 . Ряд других свойств состояний также определяются числом
. Ряд других свойств состояний также определяются числом 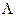 , поэтому электронные состояния классифицируют по значению этого числа:
, поэтому электронные состояния классифицируют по значению этого числа:
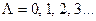
соответствуют символам
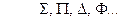
Магнитное поле, связанное с орбитальным моментов электронов, определяется проекцией орбитального момента на межъядерную ось, т.е. определяется квантовым числом 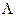 и направлено вдоль межъядерной оси.
и направлено вдоль межъядерной оси.
Для 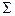 -состояний напряженность магнитного поля равна 0, для других – пропорциональна числу
-состояний напряженность магнитного поля равна 0, для других – пропорциональна числу 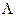 .
.
Спин, компонеты мультиплета. Квадрат вектора суммарного спина всех электронов  определяется квантовым числом
определяется квантовым числом 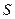 суммарного спина.
суммарного спина.
S2 = 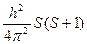
Квантовое число 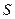 может быть целым (при четном количестве электронов) и полуцелым (при нечетном количестве электронов). Проекция суммарного вектора на межъядерную ось будет
может быть целым (при четном количестве электронов) и полуцелым (при нечетном количестве электронов). Проекция суммарного вектора на межъядерную ось будет
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
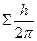
где 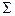 - квантовое число проекции суммарного спина – может быть равно одному из чисел:
- квантовое число проекции суммарного спина – может быть равно одному из чисел: 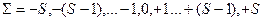 (не путать с
(не путать с 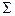 , определяющим квантовое состояние
, определяющим квантовое состояние  ).
).
Совокупность 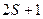 состояний, имеющих одно и тоже значение
состояний, имеющих одно и тоже значение 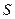 и разные значения
и разные значения 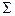 , называется мультиплетом, а отдельные состояния – компонентами мультиплета. Энергия компонента мультиплета определяется напряженностью внутреннего магнитного поля молекулы, пропорциональной
, называется мультиплетом, а отдельные состояния – компонентами мультиплета. Энергия компонента мультиплета определяется напряженностью внутреннего магнитного поля молекулы, пропорциональной 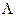 , и проекцией
, и проекцией 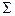 суммарного вектора спина на межъядерную ось. Если обозначить среднюю энергию мультиплета через
суммарного вектора спина на межъядерную ось. Если обозначить среднюю энергию мультиплета через 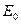 , то энергии отдельных его компонент может быть выражена:
, то энергии отдельных его компонент может быть выражена:
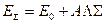
Например, для состояния 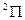 (
(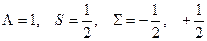 ):
):
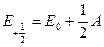
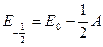
Каждый компонент мультиплета может быть охарактеризован суммарной проекцией орбитального и спинового моментов на межъядерную ось. Квантовое число этой проекции равно 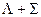 . Отдельные компоненты мультиплета обозначаются символом состояния и значением
. Отдельные компоненты мультиплета обозначаются символом состояния и значением 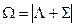 , которое ставится как нижний индекс справа. В примере
, которое ставится как нижний индекс справа. В примере
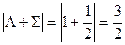
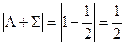
И компоненты дублета будут обозначаться как 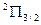 и
и 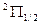 .
.
|
|
