
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Изучение кинетики электрохимических реакций хронопотенциометрическим методом
|
|
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Сущность хронопотенциометрии состоит в снятии кривых зависимости потенциала электрода от времени при прохождении через электролитическую ячейку постоянного тока заданной величины. Хронопотенциометрия позволяет решать следующие задачи электрохимической кинетики:
1. Определение коэффициентов диффузии.
2. Определение электродной поляризации и механизма электродных реакций.
3. Определение констант скоростей химических реакций, связанных с электродными процессами.
4. Определение концентрации разряжающихся ионов.
Электрохимическая ячейка содержит рабочий - индикаторный и вспомогательный электроды и электрод сравнения, относительно которого измеряется потенциал рабочего электрода.
Экспериментатора обычно интересует только процесс, протекающий на индикаторном электроде. В общем виде этот процесс может быть представлен реакцией
Ox + ne 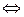 Red, (1)
Red, (1)
где Ox и Red – окисленная и восстановленная формы вещества соответственно; n – число электронов, участвующих в электродном процессе; е – элементарный заряд.
Любая электрохимическая реакция состоит из ряда последовательных стадий. Участники реакции должны доставляться к поверхности электродов – стадия массопереноса или диффузии, затем они могут претерпевать химическое превращение, переводящее их в более реакционноспособную форму – стадия предшествующей химической реакции. После этого происходит присоединение или освобождение одного или нескольких электронов (восстановление или окисление), которое может протекать в одну или несколько стадий –в целом это стадия разряда-ионизации или стадия переноса электрона. После собственно электрохимической стадии должно происходить удаление продуктов реакции.
При стационарном протекании электрохимической реакции скорости всех стадий одинаковы, но скорость суммарной реакции определяется скоростью самой медленной стадии, которая называется лимитирующей.
При замедленной стадии массопереноса реакция является обратимой, при замедленной стадии разряда-ионизации реакция является необратимой.
Если на индикаторном электроде протекает обратимый электродный процесс, его потенциал описывается уравнением Нернста
φ = φ о + 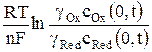 , (2)
, (2)
где gОx и gRed –коэффициенты активности окисленной и восстановленной форм ионов; cOx(0, t) и cRed(0, t) – концентрации окисленной и восстановленной форм у поверхности электрода за пределами двойного электрического слоя в любой момент времени поляризации t.
Зависимости концентраций окисленной и восстановленной форм у поверхности электрода от времени, полученные решением уравнений второго закона Фика, описываются выражениями
cOx(0, t) = 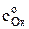 –
– 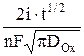 , (3)
, (3)
cRed(0, t) = 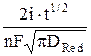 , (4)
, (4)
где 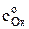 – концентрация окисленной формы в растворе в начальный момент времени при t = 0; i – плотность тока, А/м2; DОx и DRed – коэффициенты диффузии окисленной и восстановленной форм, соответственно, м2/с; F – число Фарадея, Кл/(моль эквивалентов). Размерность концентраций равна моль/м3, времени – с.
– концентрация окисленной формы в растворе в начальный момент времени при t = 0; i – плотность тока, А/м2; DОx и DRed – коэффициенты диффузии окисленной и восстановленной форм, соответственно, м2/с; F – число Фарадея, Кл/(моль эквивалентов). Размерность концентраций равна моль/м3, времени – с.
В уравнении (4) принято, что в начальный момент времени концентрация восстановленной формы в растворе равна нулю.
Подставляя уравнения (3) и (4) в уравнение Нернста можно получить уравнение хронопотенциометрической кривой
φ = φ 1/2 + 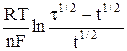 , (5)
, (5)
где t – переходное время – предельное время, по истечении которого концентрация разряжающегося иона у поверхности электрода падает до нуля; t – текущее время, t < t; φ 1/2 = φ о + 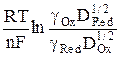 – потенциал полуволны, φ = φ 1/2 при t = t/4.
– потенциал полуволны, φ = φ 1/2 при t = t/4.
Переходное время определяют по хронопотенциометрической кривой графическим методом (рис.1).
Для хрононотенциометрии с постоянным током между t и 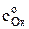 существует связь, описываемая уравнением Санда
существует связь, описываемая уравнением Санда
t1/2 = 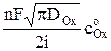 . (6)
. (6)
Из уравнения Санда следует, что
it1/2 = 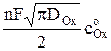
 f (i). (7)
f (i). (7)
Поэтому график в координатах it1/2 – i для обратимого процесса должен представлять собой прямую параллельную оси i. Если это не так, то электродная реакция необратима.
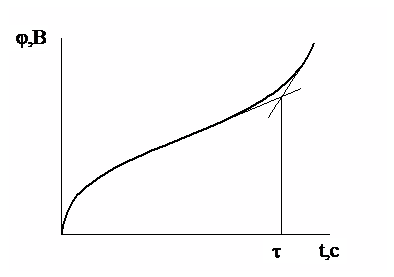 |
Рис.1. Графический метод определения переходного времени
Использование уравнения (7) дает возможность рассчитать коэффициент диффузии разряжающихся ионов, если известна их концентрация, и определить концентрации, если известен коэффициент диффузии.
В случае обратимых электродных процессов потенциал полуволны является постоянной величиной, поэтому, как видно из уравнения (5), зависимость φ = f 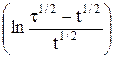 представляет собой прямую. Наклон прямой
представляет собой прямую. Наклон прямой 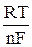 позволяет с одной стороны при данной температуре определить число электронов, участвующих в электродном процессе, а с другой, если известно теоретическое значение n – судить об обратимости реакции.
позволяет с одной стороны при данной температуре определить число электронов, участвующих в электродном процессе, а с другой, если известно теоретическое значение n – судить об обратимости реакции.
Уравнение хронопотенциограммы для необратимого электродного процесса восстановления вещества получают подстановкой выражения (3) для cOx(0, t) в кинетическое уравнение
φ = 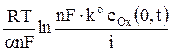 , (8)
, (8)
где ko – константа скорости реакции (1), м/с; a – коэффициент переноса, после чего получают
φ = 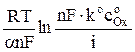 +
+ 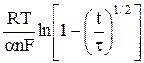 . (9)
. (9)
Из уравнения (9) следует, что для необратимых процессов линейной должна быть зависимость φ = f 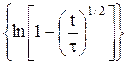 . Из наклона
. Из наклона  прямой можно при данной температуре определить величину an.
прямой можно при данной температуре определить величину an.
Для необратимого процесса потенциал электрода в начальный момент времени, т.е. при t = 0 определяется уравнением
φ = 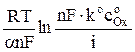 , (10)
, (10)
из которого, зная an, можно найти ko, поскольку все остальные величины известны.
Если электродный процесс протекает в смешанном режиме, когда скорости стадий массопереноса и разряда-ионизации соизмеримы, то рассматривают зависимость от времени не потенциала, а перенапряжения h, которую представляют уравнением
h(t) = – 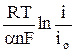 +
+ 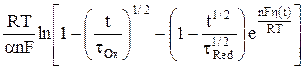 , (11)
, (11)
где tOx и tRed – переходное время соответственно для процессов восстановления и окисления; io – плотность тока обмена.
Величина перенапряжения равна разности между потенциалами электрода при пропускании тока и равновесным или стационарным потенциалом электрода при токе во внешней цепи равном нулю. Перенапряжение катодного процесса отрицательно.
Для начального момента времени, t = 0, и при условии, что в начальный момент времени концентрация восстановленной формы cRed в растворе равна нулю – в этом случае второе слагаемое под знаком логарифма, содержащее 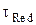 , можно опустить,
, можно опустить,
h(t=0) = – 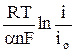 . (12)
. (12)
Выражение (12) приводится к форме уравнения Тафеля
h(t=0) = 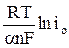 –
– 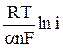 = а + b ln i, (13)
= а + b ln i, (13)
где а = 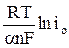 , b = –
, b = –  .
.
Из зависимости перенапряжения от логарифма плотности тока можно определить величины а и b, используя которые – рассчитать плотность тока обмена и коэффициент переноса.
Условием обратимости электродного процесса является неравенство i 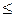 0, 2 io.
0, 2 io.
При больших перенапряжениях процесса восстановления, |h| > > 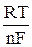 , уравнение (11) упрощается
, уравнение (11) упрощается
h(t) = – 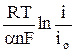 +
+ 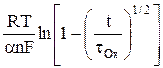 . (14)
. (14)
Из уравнения (14) видно, что во времени изменяется только лишь диффузионная составляющая поляризации, а электрохимическая составляющая должна мгновенно принимать определенное значение при t = 0. Построив графическую зависимость h(t) = f 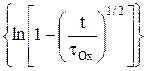 можно найти anи затем – плотность тока обмена.
можно найти anи затем – плотность тока обмена.
Плотность тока обмена связана, с константой скорости ko соотношением
io = nFko  . (15)
. (15)
Для нахождения ko уравнение (15) обычно логарифмируют, получая
ln io = ln (nFko) + a ln 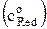 + (1–a) ln
+ (1–a) ln 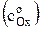 . (16)
. (16)
Если построить график ln io = f [ln 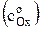 ], то получим прямую, тангенс угла наклона которой равен (1–a). Зная плотность тока обмена для ряда концентраций
], то получим прямую, тангенс угла наклона которой равен (1–a). Зная плотность тока обмена для ряда концентраций 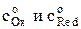 можно рассчитать константу скорости ko.
можно рассчитать константу скорости ko.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: ознакомиться с методом хронопотенциометрического исследования кинетики электродных процессов и изучить реакции электрохимического восстановления некоторых ионов по заданию преподавателя. Схема установки представлена на рис.2.
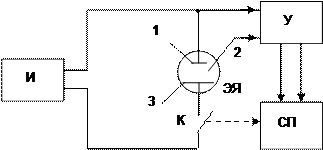 |
Рис.2. Принципиальная схема установки для снятия хронопотенциограмм.
И – регулируемый источник тока – гальваностат; ЭЯ – электрохимическая ячейка (1 – рабочий электрод; 2 – электрод сравнения; 3 – вспомогательный электрод); У – усилитель; СП – самописец или осциллограф; - К – ключ. Сплошными линиями показано направление электрического сигнала между рабочим электродом и электродом сравнения; пунктирная линия указывает, что одновременно с замыканием ключа начинает двигаться лента самописца или луч осциллографа
Предлагаемое методическое описание может быть использовано студентами при выполнении самостоятельного исследования.
1. Изучите теоретические основы хронопотенциометрического метода.
2. По указанию преподавателя приготовьте необходимые растворы.
3. Изучите установку для хронопотенциометрического исследования.
4. Выполните необходимые исследования и расчеты для определения DОx, ko, a.
По результатам работы делают выводы и вычисляют абсолютную и относительную ошибки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем обусловлено изменение потенциала электрода при хронопотенциометрическом исследовании?
2. Как можно использовать хронопотенциометрию для химического
анализа?
3. Каковы возможные причины ошибок при хронопотенциометрических исследованиях?
4. Как рассчитать константу скорости электрохимической реакции?
5. Из каких стадий состоит электрохимическая реакция?
6. Дать понятие лимитирующей стадии.
7. Пояснить понятия обратимой и необратимой электродных реакций.
8. Написать уравнение Нернста для потенциала электрода в случае обратимого электродного процесса.
9. От каких параметров зависят величины концентраций окисленной и восстановленной форм у поверхности электрода?
10. Написать и проанализировать уравнение хронопотенциограммы для обратимого процесса.
11. Пояснить понятие переходного времени.
12. Нарисовать график хронопотенциметрической кривой. Указать характерные параметры.
13. От каких параметров зависит переходное время?
14. Критерий обратимости электродного процесса в хронопотенциометрии.
15. Проанализировать уравнение (11) хронопотенциограммы для смешанной кинетики.
16. Какие величины можно определить, используя уравнение хронопотенциограммы для обратимого электродного процесса?
17. Какие величины можно определить, используя уравнение хронопотенциограммы для необратимого электродного процесса?
18. Какие величины можно определить, используя уравнение хронопотенциограммы для смешанного режима?
19. Размерности величин в уравнениях.
Приложение
ОСНОВНЫЕ ТРЕБОВАНИЯ ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНЫХ РАБОТ
1. Перед началом практикума каждый студент должен пройти инструктаж по технике безопасности и собеседование с преподавателем, во время которого выясняется степень подготовленности студента к выполнению работы,
2. Работать в лаборатории разрешается только в белых халатах.
3. Приступая к работе, студент должен иметь заранее заготовленный текст будущего отчета за исключением экспериментальных результатов и выводов. Неподготовленный студент к выполнении работы на допускается.
4. Включение собранной и подготовленной установки возможно только с разрежения преподавателя или инженера.
5. В процессе работы студент должен выполнить все требуемые измерения, расчеты и начертить необходимые графики.
6. После окончания работы он должен проанализировать свои результаты, сопоставить их с теоретическими расчетами или справочными данными, сделать краткие выводы. В конце занятия полученные результаты с их первичной обработкой предъявляют преподавателю.
7. Отчет по работе должен содержать:
- краткое теоретическое введение;
- описание методики исследования и схему установки;
- результаты в виде таблиц, графиков и уравнений, анализ погрешностей;
- выводы по работе;
- список использованной литературы.
8. Правила оформления графиков:
- все графики вычерчиваются с использованием графических программ ЭВМ, таких как EXCEL;
- масштаб выбирают с таким расчетом, чтобы использовать всё поле графика;
- экспериментальные точки четко выделяют, координатные оси обозначают с указанием размерностей;
- каждый график должен иметь подрисуночную подпись.
9. Отчеты оформляют в тетради, которую студент предъявляет при сдаче зачета и экзамена или на отдельных листах формата А4.
СПИСОК ЛИТЕРАТУРЫ
1. Дамаскин, Б.Б. Электрохимия / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина – М.: Химия, 2001, – 624 С.
2. Дамаскин, Б.Б. Практикум по электрохимии / Б.Б. Дамаскин, О.А. Петрий, Б.И. Подловченко и др. – М.: Высш. школа, 1991, – 288 С.
3. Никольский Б.П. Физическая химия. Теоретическое и практическое руководство /Б.П.Никольский, Н.А.Смирнова, М.Ю.Панов и др. – Л.: Химия, 1987, – 880 С.
4. Дамаскин Б.Б. Введение в электрохимическую кинетику / Б.Б. Дамаскин, О.А. Петрий – М.: Высш. школа, 1975, – 416 С.
5. Галюс, З. Теоретические основы электрохимического анализа / З. Галюс – М.: Мир, 1974, - 552 С.
6. Методы измерения в электрохимии Т1, Т2 / Ред. Э. Егер, А. Залкинд – М.: Мир, 1977, – 586 С, 476 С.
7. Левин, А.И. Лабораторный практикум по теоретической электрохимии / А.И.Левин, А.В. Помосов – М.: Металлургия, 1966, - 296 С.
0СОДЕРЖАНИЕ
| РАБОТА l ПРОВЕРКА ВЫПОЛНИМОСТИ ЗАКОНА ФАРАДЕЯ | |
| РАБОТА 2 ОПРЕДЕЛЕНИЕ ЧИСЕЛ ПЕРЕНОСА В ИОННЫХ ПРОВОДНИКАХ | |
| РАБОТА 3 ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА БЕЗ ПЕРЕНОСА | |
| РАБОТА 4 УСТАНОВЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ МЕТОДОМ ЭДС | |
| РАБОТА 5 ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА | |
| РАБОТА 6 ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ МАЛОРАСТВОРИМОГО СОЕДИНЕНИЯ | |
| РАБОТА 7 ОПРЕДЕЛЕНИЕ СТАНДАРТНОГО ОКИСЛИТЕЛЬНО- ВОСТАНОВИТЕЛЬНОГО ПОТЕНЦИАЛА | |
| РАБОТА 8 ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ | |
| РАБОТА 9 ОПРЕДЕЛЕНИЕ СРЕДНЕЙ АКТИВНОСТИ И СРЕДНЕГО КОЭФФИЦИЕНТА АКТИВНОСТИ СОЛЯНОЙ КИСЛОТЫ МЕТОДОМ ЭДС | |
| РАБОТА 10 ОПРЕДЕЛЕНИЕ ЕМКОСТИ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ | |
| РАБОТА 11 ПЕРЕНАПРЯЖЕНИЕ РАЗРЯДА ИОНОВ ВОДОРОДА | |
| РАБОТА 12 ПЕРЕНАПРЯЖЕНИЕ ДИФФУЗИИ ПРИ КАТОДНОМ ВОССТАНОВЛЕНИИ ПЕРОКСИДА ВОДОРОДА | |
| РАБОТА13 ПОЛЯРОГРАФИЧЕСКОЕ ИССЛЕДОВАНИЕ КИНЕТИКИ ЭЛЕКТРОДНОГО ПРОЦЕССА | |
| РАБОТА 14 ИЗУЧЕНИЕ КИНЕТИКИ ЭЛЕКТРОХИМИЧЕСКИХ РЕАКЦИЙ ХРОНОПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ | |
| ПРИЛОЖЕНИЕ ОСНОВНЫЕ ТРЕБОВАНИЯ ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНЫХ РАБОТ | |
| СПИСОК ЛИТЕРАТУРЫ |
|
|
