
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть. Тепловой эффект реакции нейтрализации азотной кислоты гидроксидом калия измеряют в калориметрической установке
|
|
Тепловой эффект реакции нейтрализации азотной кислоты гидроксидом калия измеряют в калориметрической установке, схема которой изображена на рис. 1. Она состоит из двух калориметрических сосудов: наружного 4 и внутреннего 3. Во избежание потерь теплоты через стенки калориметрического сосуда он помещается на подставку из пенопласта (материал с малой теплопроводностью). Калориметр закрывается крышкой 5 с тремя отверстиями: для воронки 2, мешалки 1 и термометра 6.
 |
Рис. 1. Калориметрическая установка:
1 – мешалка; 2 – воронка; 3 – внутренний калориметрический сосуд; 4 – наружный калориметрический сосуд; 5 – крышка; 6 – термометр
Выполнение опыта. Перед началом опыта узнать массу калориметрической установки у лаборанта.
Собрать калориметрическую установку и через воронку в калориметрический сосуд налить отмеренные мерным цилиндром 50 мл 1 М раствора HNO3. Во второй мерный цилиндр налить
50 мл 1 М раствора KOH и поставить его на 3–4 мин для выравнивания температуры рядом с калориметром.
Опустить термометр в стакан с раствором щелочи и замерить температуру раствора (Т щёлочи) с точностью до 0, 1 К. Затем, ополоснув шарик термометра водой и осушив его фильтровальной бумагой, опустить термометр в раствор кислоты. Замерить температуру раствора кислоты (Т кислоты).
Через воронку вылить раствор щелочи в кислоту и, непрерывно перемешивая раствор мешалкой, измерять температуру. Отметить самую высокую температуру Т к. Результаты измерений занести в табл. 1, форма которой приведена ниже.
Таблица 1
Результаты измерений температуры
| Масса калориметрического сосуда m, кг | Суммарный объем жидкости в стакане V, мл | Температура, К | ||
| Т щёлочи | Т кислоты | Т к | ||
Запись результатов опыта. Составить термохимическое уравнение проведенной реакции. Рассчитать её тепловой эффект и относительную погрешность опыта. Ход расчёта следующий:
1. Вычислить суммарную теплоемкость системы по формуле
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
å С = с 1 m 1 + c 2 m 2 + c 3 m 3=
где å С – суммарная теплоемкость системы; c 1, c 2 – удельные теплоемкости растворов кислоты и щелочи, принимаемые равными удельной теплоемкости воды, 4, 19 кДж/(кг× К); с 3 – удельная теплоемкость стекла 0, 75 кДж/(кг× К); m 1, m 2 – массы растворов кислоты и щелочи, кг (плотности растворов кислоты и щелочи принять
равными плотности воды, 1000 кг/м3); m 3 – масса калориметра, кг.
2. Вычислить теплоту, выделяющуюся или поглощающуюся
в калориметре, по формуле
q = å С (Т к – Т н) =
где Т к– конечная температура жидкости в калориметре, К; Т н – начальная температура жидкости, К, определяемая по формуле
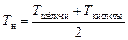 =
=
3. Рассчитать число молей нейтрализованной кислоты (щелочи) n, учитывая заданную молярную концентрацию и объем раствора. В 1000 мл раствора содержится 1 моль кислоты (или щелочи), в 50 мл содержится в 200 раз меньше, т. е. 1/200 = 0, 05 моль.
4. Рассчитать изменение энтальпии реакция нейтрализации (кДж/моль) по формуле
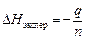 =
=
5. Рассчитать относительную погрешность δ отн (%), сравнивая полученную в результате расчёта энтальпию  с теоретической
с теоретической 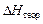 :
:
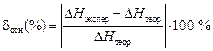 =
=
где 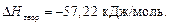
Вывод:
|
|
