
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные теоретические сведения. Цель работы –приобретение навыков определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием с использованием калориметрической
|
|
Лабораторная работа 2
ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
Цель работы – приобретение навыков определения теплового эффекта реакции нейтрализации сильной кислоты сильным основанием с использованием калориметрической установки.
Основные теоретические сведения
При прохождении большинства химических реакций теплота Q выделяется (реакция экзотермическая) или поглощается (реакция эндотермическая). Уравнения реакций, в которых количество выделенной или поглощенной теплоты Q записывается как член уравнения, называются термохимическими уравнениями. Теплота, входящая в термохимическое уравнение как продукт реакции, называется тепловым эффектом реакции. Например, в нижеприведенных уравнениях +483, 2 и –58, 1 кДж являются, соответственно, тепловыми эффектами экзотермической и эндотермической реакций:
 – экзотермическая;
– экзотермическая;
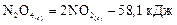 – эндотермическая.
– эндотермическая.
Величина теплового эффекта реакции относится к определенному количеству вещества. Так, 483, 2 кДж относится к образованию 2 моль газообразной воды. Тепловой эффект реакции, отнесенный к образованию 1 моль вещества из простых веществ в их устойчивых состояниях, называется теплотой образования данного вещества 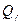 . Так,
. Так, 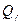 газообразной водысоставляет по уравнению
газообразной водысоставляет по уравнению
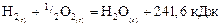
241, 6 кДж/моль.
Количество теплоты, выделившейся или поглотившейся в результате реакции, проведенной при постоянном давлении 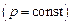 , называется энтальпией Н. Положительная величина теплового эффекта (экзотермическая реакция) соответствует отрицательной величине
, называется энтальпией Н. Положительная величина теплового эффекта (экзотермическая реакция) соответствует отрицательной величине 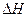 реакции и наоборот. Если
реакции и наоборот. Если 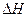 реакции относится к образованию 1 моль сложного вещества из простых веществ, то оно называется энтальпией образования вещества
реакции относится к образованию 1 моль сложного вещества из простых веществ, то оно называется энтальпией образования вещества 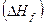 .
.
Величина энтальпии зависит от агрегатного состояния, количества и концентраций веществ, парциальных давлений газообразных компонентов, а также от условий проведения опыта. В справочниках обычно приводятся стандартные энтальпии образования 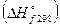 , которые относятся к образованию 1 моль соединения из простых веществ в их устойчивых состояниях при
, которые относятся к образованию 1 моль соединения из простых веществ в их устойчивых состояниях при  и
и 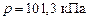 .
. 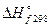 простых веществ в их устойчивых состояниях принимаются равными нулю.
простых веществ в их устойчивых состояниях принимаются равными нулю.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Важно знать, к какому агрегатному состоянию относится  . Например, уровень энтальпии газообразной воды лежит выше уровня энтальпии жидкой воды. Это связано с тем, что при фазовом переходе
. Например, уровень энтальпии газообразной воды лежит выше уровня энтальпии жидкой воды. Это связано с тем, что при фазовом переходе 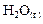 →
→ 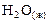 выделяется теплота конденсации [1].
выделяется теплота конденсации [1].
Жидкую воду можно получить из водорода и кислорода двумя путями.
Первый путь: 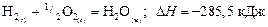 .
.
Второй путь: 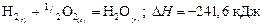 ,
,
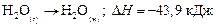 .
.
В обоих случаях энтальпия образования жидкой воды составит –285, 5 кДж/моль, т. е. 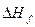 не зависит от способа получения вещества. В этом заключается основной закон термохимии, открытый в 1840 г. русским химиком Г. И. Гессом. Смысл его состоит
не зависит от способа получения вещества. В этом заключается основной закон термохимии, открытый в 1840 г. русским химиком Г. И. Гессом. Смысл его состоит
в том, что изменение энтальпии в ходе химической реакции определяется только видом и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от начальных веществ к конечным.
Для термохимических расчетов обычно используют следствия из закона Гесса, которые позволяют определить тепловые эффекты многочисленных химических реакций, не прибегая к измерениям.
Первое следствие из закона Гесса показывает, что изменение энтальпии химической реакции при стандартных условиях равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ:
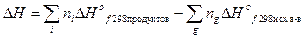 ,
,
где 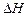 – энтальпия химической реакции;
– энтальпия химической реакции; 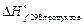
и 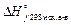 – стандартные теплоты образования, соответственно, продуктов реакции и исходных веществ (приводятся в справочных таблицах); ni и ng – стехиометрические коэффициенты перед формулами соответствующих веществ в уравнении реакции.
– стандартные теплоты образования, соответственно, продуктов реакции и исходных веществ (приводятся в справочных таблицах); ni и ng – стехиометрические коэффициенты перед формулами соответствующих веществ в уравнении реакции.
Стандартные энтальпии образования 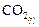 и
и 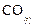 соответственно равны –393, 5 и –110, 5 кДж/моль (по данным справочных таблиц [3]).
соответственно равны –393, 5 и –110, 5 кДж/моль (по данным справочных таблиц [3]). 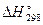 образования
образования 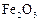 обозначим через x. Тогда
обозначим через x. Тогда 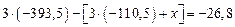 , откуда
, откуда 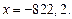 Таким образом,
Таким образом, 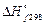
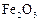 составляет –822, 2 кДж/моль.
составляет –822, 2 кДж/моль.
Второе следствие из закона Гесса показывает, что изменение энтальпии химической реакции при стандартных условиях равно сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции:
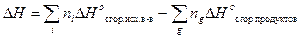 ,
,
где 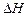 – энтальпия химической реакции;
– энтальпия химической реакции; 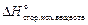
и 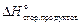 – стандартные теплоты сгорания, соответственно, исходных веществ и продуктов реакции (приводятся в справочнике); ni и ng – стехиометрические коэффициенты перед формулами соответствующих веществ в уравнении реакции.
– стандартные теплоты сгорания, соответственно, исходных веществ и продуктов реакции (приводятся в справочнике); ni и ng – стехиометрические коэффициенты перед формулами соответствующих веществ в уравнении реакции.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Стандартной энтальпией сгорания 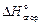 называется тепловой эффект реакции сгорания 1 моль вещества при стандартных условиях с образованием
называется тепловой эффект реакции сгорания 1 моль вещества при стандартных условиях с образованием 
Второе следствие из закона Гесса используют для расчёта тепловых эффектов реакций, в которых участвуют органические вещества, так как для этих веществ проще определить теплоту сгорания, чем теплоту образования.
Тепловые эффекты, сопровождающие химические реакции, измеряют в калориметрических установках различных конструкций. Так, тепловой эффект нейтрализации 1 эквивалента любой сильной кислоты любым сильным основанием в разбавленных водных растворах, измеренный с помощью калориметра, составляет –57, 22 кДж/моль при 298 К, то есть не зависит от природы исходных веществ, а взаимодействие определяется реакцией:
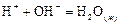
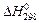 = –57, 22 кДж/моль.
= –57, 22 кДж/моль.
Этот факт подтверждает полную диссоциацию сильных электролитов в водных растворах. Например, нейтрализация азотной кислоты гидроксидом калия в разбавленных водных растворах сводится к образованию 1 моль жидкой воды и сопровождается тепловым эффектом –57, 22 кДж/моль:
НNO3 + KOH = KNO3 + H2O(ж);
Н+ + NOˉ 3 + K+ + OHˉ = K+ + NOˉ 3 + H2O(ж);
Н+ + ОНˉ = Н2О(ж) 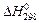 = –57, 22 кДж/моль.
= –57, 22 кДж/моль.
При нейтрализации слабых кислот и слабых оснований энтальпия нейтрализации меньше, так как при ионизации кислоты и основания затрачивается энергия.
|
|
