
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ковалентная связь.
|
|
Тема. Химическая связь.
Основные типы химической связи: ковалентная, ионная, металлическая, водородная.
Сравнение разных видов химической связи.
| Признак для сравнения | Ковалентная связь | Ионная связь | Металлическая связь |
| Способ образования. | Образование общей пары электронов | Взаимное притяжение разноименных заряженных электронов | Электростатическое притяжение ионов металла и свободных электронов |
| Природа атомов и ионов, которые участвуют в образовании связи. | Преимущественно неметаллы | Преимущественно ионы металла и неметалла | Ионы металла и свободные электроны |
| Кристаллическая решетка. | Молекулярная или атомная решетка | Ионная кристаллическая решетка | Металлическая решетка |
Ковалентная связь.
Связь, осуществляемая посредством общих электронных пар, называется ковалентной.
Ковалентная связь бывает полярной и неполярной.
Ковалентная неполярная связь – химическая связь образованная атомами с одинаковой электроотрицательностью.
Образование связи в молекуле водорода:
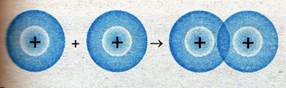
Образование связей в молекуле хлора:
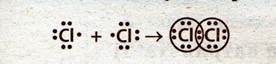
Схема перекрывания р-орбиталей в молекуле хлора:
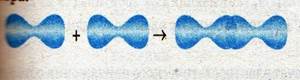
Физические свойства. Вещества, молекулы которых неполярны, лучше растворяются в неполярных растворителях (например, в бензоле).
Ковалентная полярная связь – химическая связь, образованная атомами, элекроотрицательности которых отличаются незначительно.
Образование общей электронной пары по общему механизму.
Образование связи в молекуле хлороводорода:
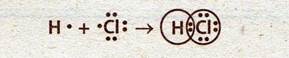
Схема перекрывания s- и р-орбиталей в молекуле хлороводорода:
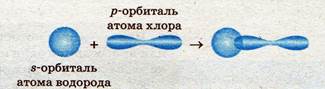
Образование связи по донорно-акцепторному механизму.
Один атом (акцептор) предоставляет свободную орбиталь, а другой (донор) отдает непоселенную пару электронов:

Физические свойства. Вещества, молекулы которых полярны в растворенном и расплавленном состоянии, проводят электрический ток, хорошо растворяются в полярных растворителях (например, в воде)
|
|
