
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ТЕМА: Люмінесцентний спектральний аналіз. Рефрактометрія.
|
|
План:
1. Виникнення люмінесценції, класифікація люмінесцентних процесів.
2. Шляхи дезактивації енергії електронного збудження. Схема Яблонського.
3. Основні характеристики випромінювальних процесів (час життя, квантовий вихід). Закон Стокса-Ломеля.
4. Кількісний та якісний люмінесцентний аналіз.
5. Суть рефрактометричного методу аналізу. Показник заломлення.
6. Залежність показника заломлення від природи речовини, довжини хвилі світла, температури та тиску. Дисперсія.
7. Питома та молярна рефракція. Рівняння Лорентца-Лоренца. Адитивні властивості молярної рефракції.
8. Якісний та кількісний рефрактометричний аналіз.
І. Відомо, що деякі розчини здатні світитись «холодним» світлом, яке називають люмінесцентним. Воно може бути викликане дією різних видів енергії, необхідної для переходу молекул речовини у збуджений стан. Процес повернення збуджених молекул у незбуджений (нормальний) стан, що супроводжується втратою енергії, може відбуватися безвипромінювально або за участю квантів люмінесценції. Отже, люмінесценція – явище (процес) світіння атомів, молекул, іонів, яке виникає в результаті електронного переходу в частинках при їх поверненні зі збудженого в основний стан.
Класифікують явища люмінесценції за часом і методом збудження.
За часом післясвітіння розрізняють:
а) флуоресценцію – світіння, яке миттєво згасає після припинення дії джерела збудження.
б) фосфоресценцію – світіння, яке продовжується певний проміжок часу після припинення збудження.
За методом збудження:
· фотолюмінесценцію – світіння, яке виникає при поглинанні світла в УФ або видимій ділянці спектру.
· хемілюмінесценцію – світіння, яке виникає внаслідок протікання екзотермічних реакцій. Як відомо, цей процес відбувається внаслідок термічної активації молекул, тобто переводу молекул із основного в збуджений стан за допомогою температури. Але, для того, щоб більшу кількість молекул перевести з основного в збуджений стан, а це відстань Δ Е=200-400 кДж/моль (енергія електронного збудження), необхідні вкрай високі температури. Як органічні, так і координаційні сполуки в таких умовах розкладаються. Тому, цей спосіб застосовується тільки для збудження атомів і простих двоатомних молекул. Дезактивація продукту реакції відбувається шляхом випромінювання кванта світла або передачі енергії збудження інший молекулі. Таким чином, випромінювання, яке супроводжує такі процеси, називається хемілюмінесценцією.
· катодолюмінісценція – основана на світінні речовин при поглинанні катодних променів (електронів), інакше кажучи, збудження за допомогою електричного розряду. Цей спосіб збудження застосовується для інертних газів, Hg, Na, Cd. Це явище лежить в основі принципу дії ртутних і люмінесцентних джерел світлі. Стосовно молекул він є непридатним, оскільки вони або дисоціюють, або деструктивно розкладаються.
Всі люмінесціюючи речовини мають загальну назву – фотолюмінофори.
2. Після поглинання кванта світла (УФ- або видимого діапазону) і переходу в електронно-збуджений стан, молекула довго в ньому перебувати не може і тим чи іншим шляхом втрачає запас енергії. Існують три основних шляхи дезактивації:
· внутрішньомолекулярні процеси;
· міжмолекулярна взаємодія;
· фотохімічні реакції.
Внесок кожного з них в загальну втрату енергії електронного збудження молекули визначається відносними величинами їх констант швидкості.
Фотофізичні процеси розрізняють за способом повернення набутої енергії:
1. випромінювальні переходи (з випромінюванням кванта світла) – флуоресценція та фосфоресценція (ці процеси відбуваються лише внутрішньомолекулярно)
2. безвипромінювальні (внутрішньо- і міжмолекулярно-) – внутрішня (ВК: S2→ S1, S1→ S0, T2→ T1) та інтеркомбінаційна конверсія (ІКК: S1→ T1, S2→ T1).
Внутрішньомолекулярні процеси дезактивації (випромінювальні та безвипромінювальні) представляють енергетичною діаграмою – схема Яблонського:
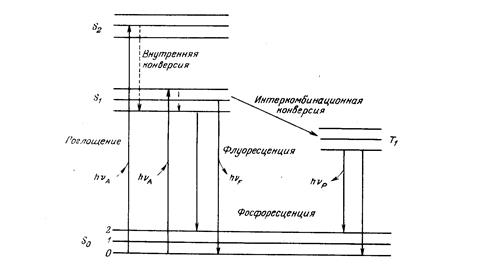
· Вищі збудженні синглетні стани S2 S3 мають час життя ~ 10-11 с, а S1~10-8 – 10-9 с.
· Перехід електронно-збудженої молекули з вищого коливального рівня на термічно рівноважний рівень називається коливальна релаксація. Він відбувається за час 10-12 с.
· Безвипромінювальні переходи між двома електронними станами однакової спінової мультіплетності (S2→ S1, S1→ S0) називається внутрішньою конверсією, а випромінювальні – флуоресценцією (вона відбувається лише з нульового коливального рівня S1-стану).
· Випромінювання світла внаслідок переходу між електронними станами різної мультіплетності (Т1→ S0) називається фосфоресценцією, а відповідні безвипромінювальні переходи – інтеркомбінаційною конверсією.
Всі ці процеси фізичної дезактивації характеризуються певною тривалістю. Тривалість перебування молекули у збудженому стані при відсутності безвипромінювальних процесів, називається випромінювальним часом життя збудженої молекули:
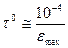 , де ε – молярний коефіцієнт світло поглинання (
, де ε – молярний коефіцієнт світло поглинання (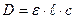 ).
).
Так, час життя флуоресценції ~10-9 с; фосфоресценції ~10-3 с.
Випромінювальні процеси (флуоресценція, фосфоресценція) характеризуються:
· Константою швидкості: константа флуоресценції (kf) дорівнює 107-108с-1; константа фосфоресценції (kр) дорівнює 102-104 с-1.
· Квантовим виходом:
Квантовий вихід флуоресценції – це відношення швидкості випромінювання станом S1 до швидкості поглинання квантів світла станом S0:
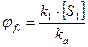
Квантовий вихід фосфоресценції – це відношення швидкості випромінювання станом Т1 до швидкості поглинання квантів світла станом S0 прямо ведучим до утворення стану Т1, тобто, до інтенсивності переходу S0→ Т1 (однак, фосфоресцентний стан отримують не прямим заселенням S0→ Т1, а внаслідок ІКК S1→ Т1):
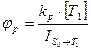
· Спектрами флуоресценції або фосфоресценції.
Звертаючись до схеми Яблонського, можна зрозуміти, що енергія випромінювання молекули завжди менша від енергії збудження, тому на основі цього твердження було встановлено, що спектр флуоресценції зміщений відносно спектру поглинання в довгохвильову область – закон Стокса-Ломеля.
Різницю між максимумом спектра поглинання і максимумом спектра флуоресценції називають стоковим зсувом. Чим більша величина стоксова зсуву для даної речовини, тим вища чутливість її визначення люмінесцентним методом.
Кількісний люмінесцентний аналіз – базується на лінійній залежності між інтенсивністю люмінесценції та концентрацією люмінесціюючої речовини:
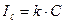
Необхідно відзначити, що лінійна залежність спостерігається лише при малих концентраціях: 10-8-10-4 моль/л, тобто, люмінесцентний метод аналізу використовують для визначення мікрокількостей речовини. Для визначення концентрації речовини використовують метод калібрувального графіка у координатах: ось Х (інтенсивність люмінесценції) – ось Y (концентрація речовини).
Якісний люмінесцентний аналіз – оснований на здатності речовин випромінювати світло після опромінення їх УФ-світлом, тобто мати свій власний, характерний лише для них спектр флуоресценції.
На положення спектру флуоресценції (здатності флуоресціювати) впливають:
· Природа речовини;
· Полярність розчинника;
· Температура;
· Концентрація речовини;
· Присутність гасників.
Ці фактори можуть змінювати (вплинути) відносне положення рівнів енергії нижчих електронно-збуджених станів молекул речовини і, тим самим, призвести до появи або зникнення флуоресценції. Тому, це необхідно враховувати при вирішенні практичних задач. Наприклад, по-різному світяться свіже зерно і зерно, яке псується. Це явище використовується для визначення його якості.
Люмінесцентний аналіз використовують також:
· В біології і медицині (флуоресцентні зонди і флуоресцентні мітки);
· В промисловості;
· Для контролю об’єктів навколишнього середовища.
Перевагою люмінесцентного аналізу в порівнянні з іншими фізико-хімічними методами є його висока чутливість, за допомогою люмінесцентного аналізу можна визначати до мільйонної долі відсотка вміст речовини.
Можна також визначати структурні зміни, які відбуваються в молекулах речовини в результаті обробки препаратами або певних процесів. Приклад: кількісне визначення вітаміну В2 (рибофлавіну). Метод заснований на здатності рибофлавіну до люмінесценції.
Прилади для люмінесцентного аналізу. Для вимірювання інтенсивності люмінесценції – лабораторний флуорометр ЄФ-3М, призначений для кількісного аналізу вітамінів та інших люмінесціюючи речовин.
ІІ. Рефрактометрія. Рефрактометріябазується на визначенні показника заломлення (n) світла розчином. Заломленням або рефракцією називають зміну напрямку прямолінійного поширення світла при переході його з одного середовища в інше. Показником заломлення (п) називають відношення синуса кута падіння променя світла α до синуса кута його заломлення β:
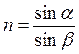 .
.
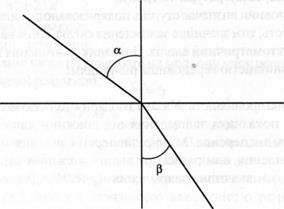 Рис.1. Заломлення променя світла.
Рис.1. Заломлення променя світла.
|
Заломлення світла, так само як і поглинання, є наслідком взаємодії його з середовищем. Внаслідок взаємодії поля електромагнітних хвиль світла в атомах речовини, через яку проходить світло, виникають вимушені коливання електронів та ядер, що призводить до зміщення " центрів ваги" позитивного та негативного зарядів в атомах. Атоми стають диполями. Так відбувається поляризація атомів та молекул, яка буває кількох типів:
- електронна - зумовлена зміщенням електронів в атомі або молекулі;
- атомна - спричинена зміщенням окремих атомів або атомних груп одних відносно інших в молекулі;
- орієнтаційна - спостерігається в речовинах, молекули яких мають сталі диполі та здатні орієнтуватися в напрямку поля.
Повна поляризація може бути представлена сумою електронної, атомної та орієнтаційної поляризацій:
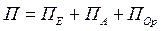 .
.
Диполі генерують вторинні хвилі, взаємодія з якими світлової хвилі призводить до виникнення результуючої хвилі. Остання поширюється у речовині зі швидкістю, відмінною від швидкості світла в первинному середовищі, і дещо в іншому напрямку. Ці явища підлягають закону заломлення світла на межі розділу двох прозорих середовищ.
Поляризовані молекули здатні заломлювати світло. Величина показника заломлення залежить від природи речовини, її густини, довжини хвилі направленого світла, температури та тиску.
Природа речовини визначає ступінь поляризованості молекул. Чим більша поляризованість, тим значніше заломлення світла. Саме на цій залежності базується рефрактометричний аналіз. Показник заломлення зв'язаний з діелектричною проникністю середовища рівнянням:
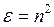 ,
,
так як діелектрична проникність зв'язана з поляризованістю молекул речовини.
Залежність показника заломлення від довжини хвилі направленого світла називають дисперсією. Мірою дисперсії є різниця між значеннями показників заломлення, виміряних при різних довжинах хвиль. Чим менша довжина хвилі, тим значніше заломлення (Рис.2).
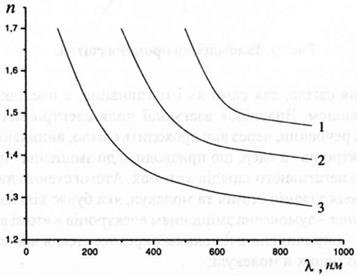 Рис.2. Залежність показника заломлення п від довжини хвилі:
1 - для скла; 2 - для кварцу; 3 - для флюориту.
Рис.2. Залежність показника заломлення п від довжини хвилі:
1 - для скла; 2 - для кварцу; 3 - для флюориту.
|
Для видимого світла найбільший коефіцієнт заломлення відповідає фіолетовому світлу, а найменший - червоному. Табличні значення показників заломлення наводять для жовтої лінії (лінії D) в спектрі натрію і позначають nD. Довжина хвилі, яка відповідає цій лінії, λ = 589 нм.
Зміни температури та тиску призводять до зміни густини речовини, а зміна густини - до зміни показника заломлення. Тому була знайдена величина, пов'язана з показником заломлення, яка відображає внутрішню структуру речовини і не залежить від зовнішніх факторів. Такою величиною є питома рефракція г:
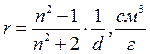 (формула Лорентца-Лоренца).
(формула Лорентца-Лоренца).
де г - питома рефракція;
d - густина речовини.
При множенні питомої рефракції на молярну масу речовини отримаємо вираз для молярної рефракції:
 .
.
Як бачимо, величина молярної рефракції визначається тільки поляризованістю молекул, тобто природою речовини, і не залежить від зовнішніх умов (температури, тиску), а, отже, і агрегатного стану речовини.
Молярна рефракція є адитивною властивістю речовини. Числове значення молярної рефракції є сумою атомних рефракцій елементів, з яких складається дана сполука; молярна рефракція суміші дорівнює сумі молярних рефракцій складових частин. Поряд з вимірюванням атомних рефракцій використовують вимірювання рефракцій зв'язків.
Наприклад, рефракція метилового спирту може бути розрахована за рефракціями атомів та рефракціями зв'язків.
· За рефракціями атомів:

· За рефракціями зв’язків:
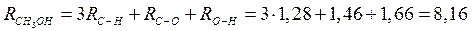 .
.
Оскільки величини R однакові, значить це і є та сама речовина:
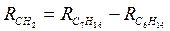 ;
;
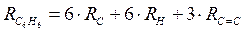 ;
;
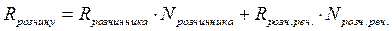 ,
,
де  і
і  - мольні долі розчинника і розчиненої речовини в розчині.
- мольні долі розчинника і розчиненої речовини в розчині.
Молярна рефракція широко використовується для визначення чистоти та встановлення структури речовини, ідентифікації органічних речовин. Якщо визначити n та d невідомої органічної речовини, то за таблицею властивостей можна орієнтовно встановити природу цієї речовини. Якщо пізніше розрахувати молярну рефракцію за формулою:
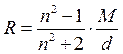
а також за сумою атомних рефракцій і рефракцій зв'язків, то збіг знайдених числових величин рефракцій служить підтвердженням висновків стосовно природи речовини.
Кількісний рефрактометричний аналіз базується на залежності показника заломлення від концентрації речовини в розчині. Наприклад, крива залежності показника заломлення розчину сахарози від концентрації сахарози має вигляд, представлений на рис.3.
Рефрактометричний аналіз використовується для визначення зв'язаної води в різноманітних продуктах, які містять високомолекулярні речовини. Суть цього визначення зводиться до наступного: певну кількість продукту, наприклад крохмалю, поміщають на 20-30 хв у водний розчин сахарози з відомою концентрацією. Відбувається зв'язування води крохмалем, внаслідок чого концентрація сахарози в розчині збільшується. За величиною зміни концентрації сахарози та наважкою крохмалю розраховують кількість зв'язаної води.
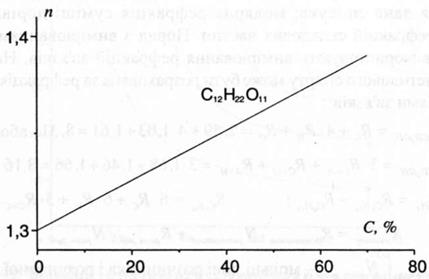 Рис.3. Калібрувальний графік для визначення сахарози.
Рис.3. Калібрувальний графік для визначення сахарози.
|
Для проведення рефрактометричних визначень користуються приладами рефрактометрами та інтерферометрами.
|
|