
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ТЕМА: ІЧ-спектроскопія. Фотометричні методи аналізу.
|
|
План:
1. Причини виникнення ІЧ-спектрів.
2. Основні типи коливань атомів в молекулах. Закон Гука.
3. Інтерпретація ІЧ-спектрів
4. Застосування ІЧ-спектроскопії.
5. Дифракційні методи дослідження.
І. ІЧ-спектроскопія заснована на властивості органічних речовин поглинати випромінювання ІЧ-діапазону електромагнітного спектру (400-400 см-1, 0, 8-1000 мкм), в одиницях енергії від 1 до 10 ккал/моль.
Куди витрачається ця енергія?
На зміну коливальної і обертальної енергії молекул внаслідок збудження коливань атомних груп в молекулі і перехід на більш високій коливальний рівень. При цьому змінюється дипольний момент молекули – виникає ІЧ-спектр. Різні молекули мають різне число коливальних рівнів – відповідно різну кількість смуг в спектрі. Кількість смуг у спектрі визначається:
1. для лінійних молекул: 3N – 5, (N – кількість атомів)
2. для нелінійних молекул: 3N – 6.
ІІ. Розрізняють два основних типи коливань в молекулах і, відповідно, два види смуг поглинання:
· валентні – коливання, які відбуваються вздовж осі зв’язку атомів (розтягування – скорочення зв’язку) – симетричні та асиметричні.
· деформаційні – зв’язані зі зміною кутів між зв’язками – площинні (ножичні та маятникові) та поза площинні (крутильні та вєєрні).
Будь-яка реальна молекула завжди коливається результуючим чином.
Принцип ІЧ-спектроскопії полягає в тому, що при опроміненні речовини ІЧ-випромінюванням з безперервно змінною частотою певні ділянки спектру опромінювання поглинаються молекулою і це призводить до збільшення амплітуди коливань відповідних зв’язків. Таким чином, промінь світла, що проходить через речовину, послаблюється в областях поглинання, при реєстрації його інтенсивності після проходження зразка, записується ІЧ-спектр.
ІЧ-спектр – це залежність пропускання Т (%) від хвильового числа ν (см-1) або λ (мкм). Складний коливальний спектр молекули можна розкласти на складові частини і приписати певним групам атомів і зв’язкам свої власні набори коливань і визначити їх походження. Деякі зв’язки, групи атомів мають частоти у спектрі не залежно від того, до складу якої молекули вони входять. Їх називають характеристичними. До них відносяться валентні коливання зв’язків: С-Н, С=О, С=С, ОН, деформаційні коливання С-Н, N-H.
Можна теоретично розрахувати частоту валентних коливань за законом Гука:
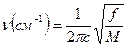 ,
,
Де: М – приведена маса, 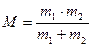 ,
,
 - силова стала, що характеризує міцність зв’язку.
- силова стала, що характеризує міцність зв’язку.
Наприклад: для зв’язку С-Н
 = 5.105 дин/см
= 5.105 дин/см
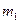 = 19, 8.10-24 г
= 19, 8.10-24 г
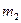 =1, 64.10-24 г, отже частота валентних коливань даного зв’язку (ν) дорівнює 3040 см-1.
=1, 64.10-24 г, отже частота валентних коливань даного зв’язку (ν) дорівнює 3040 см-1.
Область: 4000-1500 см-1 – область валентних коливань (найбільша кількість ліній);
1500-400 см-1 – область деформаційних коливань.
Для кожної речовини ці області індивідуальні.
ІІІ. Інтерпретація ІЧ-спектрів:
1. розшифровку починають з високочастотної області: 3700-2900 см-1. Це область валентних коливань зв’язків: С-Н, О-Н, > N-Н, -NН2. Ці смуги зазвичай інтенсивні.
2. далі проводять віднесення смуг в області потрійних зв’язків: С≡ С, С≡ N 2500-1900 см-1.
3. область 1300-800 см-1 – область відбитків пальців, тобто строго індивідуальна для кожної речовини. Тут велика кількість смуг, які важко віднести до певного типу коливань, оскільки вони зумовлені коливаннями карбонового скелету всієї молекули.
Наприклад, необхідно встановити структуру молекули С3Н4О, яка має смуги при частотах: 3400, 3300, 2960, 2840, 2110, 1460, 1030 см-1.
Отже: 2100 см-1 – це тільки ≡ зв'язок;
3300 см-1 – це Н поряд з карбоном при потрійному зв’язку;
3400 см-1 – це зв’язана ОН-група.
Таким чином, формула сполуки: НС≡ С-СН2-ОН.
IV. Застосування ІЧ-спектроскопії. Яку інформацію дає ІЧ-спектроскопія:
· дослідження і встановлення будови речовини;
· Встановлення ідентичності сполук;
· Вивчення внутрішньо- та міжмолекулярних взаємодій;
· Вивчення кінетики реакцій.
V. Дифракційні методи дослідження будови речовини засновані на вивченні розпреділення інтенсивності розсіяного речовиною випромінювання. Як правило, в цих методах використовують:
1. рентгенівські промені (рентгенографія);
2. прискорені електрони (електронографія);
3. нейтрони (нейтронографія).
В результаті інтерференції (складання хвиль) розсіяного випромінювання утворюється дифракційна картина – система максимумів і мінімумів, яку фіксують на фотоплівці у вигляді плям різного ступеню затемнення. Розташування дифракційних максимумів і їх інтенсивність залежать від будови аналізуємої речовини.
Рентгеноструктурний аналіз (рентгенографія) – метод дослідження просторового розташування атомів в молекулі, заснований на вивченні дифракції рентгенівських променів, які мають довжини хвиль близькі з міжатомними відстанями. За допомогою рентгеноструктурного аналізу досліджують переважно речовини в кристалічній формі.
Суть методу: рентгенівські промені (λ =10-3 – 10 нм) розсіюються внаслідок взаємодії з електронними оболонками атомів речовини. На основі дослідження дифракційної картини (рентгенограми) будують карти електронної густини молекули, з’єднуючи точки з одноковою електронною густиною безперервною лінією. З цих же даних розраховують:
· міжатомні відстані
· валентні кути
і будують просторову модель молекули.
Електронографія – метод, заснований на явищі дифракції прискорених електронів на ядрах атомів. Аналіз дифракційної картини (електронограми) дозволяє встановити:
· розташування атомів;
· між’ядерні відстані;
· валентні кути.
Використання електронографії для встановлення просторової будови органічних молекул обмежене. Можна застосувати лише для невеликих молекул, оскільки електронограма складних багатоатомних органічних молекул досить складна для розшифровки.
VI. Фотометричний метод аналізу базується на вибірковому поглинанні електромагнітного випромінювання різних ділянок спектру однорідною системою.
Основний закон фотометрії. Якщо світловий потік інтенсивністю І0 пропускати через шар речовини, то частина цього потоку Іа поглинається молекулами речовини і витрачається на зміну електронної, обертальної та коливальної енергії молекул, а частина проходить через шар речовини (розчину):
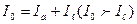
Експериментально визначають І0 та 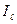 , а Іа знаходять по різниці. Бугером і Ламбертом був сформульований закон, який встановлює, що шари речовини однакової товщини завжди поглинають одну і ту ж частину падаючого на них світлового потоку. Математично ця залежність виражається рівнянням:
, а Іа знаходять по різниці. Бугером і Ламбертом був сформульований закон, який встановлює, що шари речовини однакової товщини завжди поглинають одну і ту ж частину падаючого на них світлового потоку. Математично ця залежність виражається рівнянням:
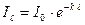
З даного рівняння одержимо: 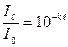
З закону Бугера-Ламберта випливає:
1. відношення 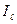 до І0 не залежить від абсолютної інтенсивності спрямованого світлового потоку;
до І0 не залежить від абсолютної інтенсивності спрямованого світлового потоку;
2. якщо товщина шару збільшується в арифметичній прогресії, то 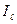 зменшується в геометричній прогресії.
зменшується в геометричній прогресії.
Наприклад: 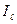 після проходження через шар розчину зменшилась у 10 разів, тобто
після проходження через шар розчину зменшилась у 10 разів, тобто 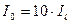 , тоді:
, тоді: 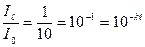 ;
; 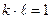 ;
; 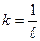 .
.
Отже, коефіцієнт поглинання 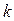 чисельно дорівнює оберненому значенню товщини шару розчину, який послаблює інтенсивність світла, що проходить через у 10 разів.
чисельно дорівнює оберненому значенню товщини шару розчину, який послаблює інтенсивність світла, що проходить через у 10 разів.
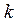 - залежить лише від природи розчиненої речовини та довжини хвилі λ, тобто закон поглинання світла Бугера-Ламберта справедливий лише для монохроматичного світла.
- залежить лише від природи розчиненої речовини та довжини хвилі λ, тобто закон поглинання світла Бугера-Ламберта справедливий лише для монохроматичного світла.
Вивчаючи поглинання світла розчинами, Бер встановив, що коефіцієнт поглинання 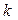 пропорційний концентрації речовини в розчині (С), що поглинає світло:
пропорційний концентрації речовини в розчині (С), що поглинає світло: 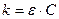 ,
,
де ε – коефіцієнт, що не залежить від концентрації.
Об’єднуючи закони Бугера-Ламберта і Бера, одержимо рівняння основного закону фотометрії – закону Бугера-Ламберта-Бера:
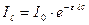 ,
,
Якщо: с – моль/л, 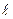 - см, то ε – молярний коефіцієнт світло поглинання, він є сталою величиною, яка залежить від λ, природи розчиненої речовини і не залежить від концентрації.
- см, то ε – молярний коефіцієнт світло поглинання, він є сталою величиною, яка залежить від λ, природи розчиненої речовини і не залежить від концентрації.
Молярний коефіцієнт світлопоглинання ε є мірою поглинальної здатності речовини і є величиною характеристичною для кожної речовини.
В логарифмічній формі закон Бугера-Ламберта-Бера:
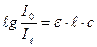
Величину 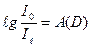 було названо оптичною густиною.
було названо оптичною густиною.
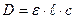 ,
, 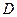 може приймати значення від 0 до ∞, однак сучасні прилади вимірюють оптичну густину до 2.
може приймати значення від 0 до ∞, однак сучасні прилади вимірюють оптичну густину до 2.
Величину 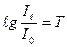 було названо світлопропускання розчину, яке може змінюватись від 0 до 1. Величини
було названо світлопропускання розчину, яке може змінюватись від 0 до 1. Величини 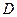 і Т зв’язані між собою співвідношенням:
і Т зв’язані між собою співвідношенням:
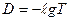
Оптична густина і світлопропускання є основними величинами, які характеризують світлопоглинання розчинів.
Який фізичний зміст ε? З рівняння 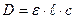 видно, якщо с=1 моль/см,
видно, якщо с=1 моль/см, 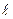 =1 см, то
=1 см, то 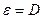 , тобто молярний коефіцієнт світлопоглинання чисельно дорівнює оптичній густини одномолярного розчину, що знаходиться в кюветі з товщиною шару 1 см. ε є мірою поглинальної здатності розчину при певній довжині хвилі. Залежність ε від λ зображується кривою і називається спектром поглинання. Для одержання спектру поглинання вимірюють значення
, тобто молярний коефіцієнт світлопоглинання чисельно дорівнює оптичній густини одномолярного розчину, що знаходиться в кюветі з товщиною шару 1 см. ε є мірою поглинальної здатності розчину при певній довжині хвилі. Залежність ε від λ зображується кривою і називається спектром поглинання. Для одержання спектру поглинання вимірюють значення 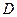 для різних λ і будують графік:
для різних λ і будують графік:  - λ або ε – λ.
- λ або ε – λ.
Спектр поглинання є індивідуальною характеристикою даної речовини, оскільки різні речовини поглинають світлову енергію певних довжин хвиль. На вивченні спектрів поглинання базується якісний фотометричний аналіз речовин, що поглинають світло, в тому числі і виявлення багатьох функціональних груп в органічних речовинах.
Кількісний фотометричний аналіз базується на застосуванні закону Бугера-Ламберта-Бера для визначення концентрації речовин у розчині. Закон передбачає лінійну залежність між величиною світлопоглинання  та концентрацією даної речовини:
та концентрацією даної речовини: 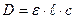 .
.
Кількісний аналіз за світлопоглинанням поділяють на:
· фотоколориметрію – це метод аналізу, в основі якого лежить визначення поглинання поліхроматичного випромінювання у видимій ділянці спектру (400-700 нм);
· спектрометрію – це метод аналізу з застосуванням монохроматичного випромінювання як у видимій, так і в УФ- та ІЧ- ділянках спектру (300-900 нм).
У кількісному фотометричному аналізі при визначенні концентрації речовини вибирають таку спектральну ділянку, для якої досягається максимальне значення світло поглинання та спостерігається максимальна чутливість методу.
Для одержання монохроматичного випромінювання певної довжини хвилі використовують світлофільтри. Світлофільтри – це певні об’єкти, які здатні пропускати промені світла у вузькому інтервалі довжини хвиль. У КФК-2 використовують забарвлені скельця.
Вибір світлофільтру для вимірювань: основна умова – щоб ділянка максимального світло поглинання забарвленого розчину збігалася з ділянкою максимального пропускання світлофільтру. Світлофільтр також можна підібрати дослідним шляхом. Для цього вимірюють оптичну густину розчину почергово при всіх наявних світлофільтрах і той СФ, при якому досягається максимальне значення оптичної густини і є найпридатнішим для фотометрування даного розчину.
Прилади для фотометричних вимірювань: КФК та спектрофотометри (СФ). При використанні КФК концентрацію дослідного розчину визначають такими методами:
1. Метод стандартів (метод порівняння): вимірюють 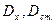 розчинів при однаковій товщині поглинаючого шару (товщині кювети). Застосувавши основний закон світло поглинання:
розчинів при однаковій товщині поглинаючого шару (товщині кювети). Застосувавши основний закон світло поглинання: 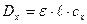 ;
; 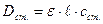 отримаємо
отримаємо
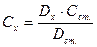
2. Метод добавок: визначають 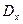 , додають до нього відому кількість речовини, що визначається (добавка) Са і знову вимірюють
, додають до нього відому кількість речовини, що визначається (добавка) Са і знову вимірюють 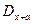 , далі:
, далі:
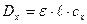 і
і  і таким чином отримуємо
і таким чином отримуємо 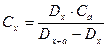
3. Метод калібрувального графіка – він є найзручнішим при серійних визначеннях концентрацій.
|
|