
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Метод полуреакций или ионно-электронный метод.
|
|
Этот метод основан на составлении ионных уравнений для процессов окисления восстановителя и для реакций восстановления окислителя с последующим суммированием обеих уравнений в общее ионное уравнение.
Степень окисления при этом определять не нужно, так как рассматривается участие в реакции не отдельного атома, а реального иона.
Чтобы составить уравнение окислительно-восстановительной реакции методом полуреакций, необходимо: 1)составить ионно-молекулярную схему реакции, помня, что сильные электролиты записываются в виде ионов, а слабые электролиты, газы, осадки - в виде молекул. В ионную схему включаются только те частицы (ионы, атомы, молекулы), которые подвергаются изменению, т.е. окислитель, восстановитель, а также ионы Н+ и ОН-, характеризующие среду, или молекула воды; 2)составить электронно-ионные уравнения отдельно для процессов восстановления и окисления, руководствуясь следующими правилами:
· Если продукт реакции содержит меньше кислорода, чем исходное вещество, то в кислой среде освобождающийся кислород связывается с ионами Н+, в результате чего образуется столько молекул воды, сколько не хватает атомов кислорода. В нейтральной и щелочной средах освобождающийся кислород взаимодействует с водой, образуя удвоенное число гидроксильных групп.
· Если исходное вещество содержит меньше атомов кислорода, чем продукт реакции, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных – за счет удвоенных гидроксильных групп.
На основании закона сохранения массы и энергии должно быть равенство числа частиц (ионов, атомов, молекул) в левой и правой частях уравнения. Суммарное число и знак электрических зарядов слева и справа от знака равенства должны быть одинаковы.
Пример.
Рассмотрим реакцию восстановления перманганата калия по схеме
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
 |
KMnO4 +Na2SO4 + H2SO4 MnSO4 + Na2SO4 + K2SO4 + H2O:
1) в кислой среде. Запишем:
 |
K++(MnO4)-+2Na++(SO3)2-+2H++(SO4)2-
Mn2++(SO4)2-+2Na++(SO4)2-+2K++(SO4)2-+H2O
Составляем ионно-молекулярную схему реакции, показывающую ионы, претерпевшие изменения и ионы среды.
 |
(MnO4)- + (SO3)2- + H+ Mn2+ + (SO4)2- + H2O
Составляем схемы превращений ионов.
 |  |
(SO3)2- (SO4)2- (MnO4)- (Mn)2+
Недостаток кислорода восполним молекулой воды, т. к. среда кислая, и уравняем число атомов водорода:
(SO3)2- + H2O = (SO4)2- +2H+
(MnO4)- + 8H+ = Mn2+ + 4H2O
Сосчитаем заряды в левой и правой частях схемы и найдем число отданных и принятых электронов.

 5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
5 (SO3)2- + H2O - 2e- = (SO4)2- + 2 H+ процесс окисления
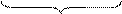 | 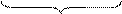 |
10 -2 0
восстановитель
2 (MnO4)- + 8H+ + 5e- = Mn2+ + 4H2O процесс восстановления
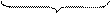 | 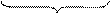 |
+7 +2
окислитель
Уравниваем число отданных и принятых электронов, найдя множители 2 и 5. Умножаем каждое уравнение на соответствующий множитель и почленно складываем их (кроме электронов), получаем:
5(SO3)2- + 5H2O +2(MnO)- +16H+ = 5(SO4)2- +10H+ + 2Mn2+ +8H2O
Приводим подобные члены:
5(SO3)2- + 2(MnO4)- + 6H+ = 5(SO4)2- + 2Mn2+ + 3H2O.
От полученного ионно-молекулярного уравнения переходим к полному молекулярному уравнению, приписывая противоионы и не нарушая общего равенства уравнения:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 3H2O
2)в нейтральной среде:
 |
KMnO4 + Na2SO3 + H2O MnO2 + KOH + Na2SO3
 |
K+ +(MnO4)- +2Na+ +(SO3)2 +H2O MnO2 +K+ +OH- +2Na+ +(SO3)2-
 |
(MnO4)- +(SO3)2 +H2O MnO2 + OH +(SO3)2-
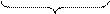


 2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
2 (MnO4)- + 2H2O +3e = (MnO2)- + 4OH- процесс восстановления
6 -1 -4
3 (SO3)2- + H2O – 2e = (SO4)2- + 2H+ процесс окисления
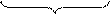 | 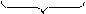 |
-2 0
2MnO4- + 4H2O + 3SO32- + 3H2O = 2MnO2 + 8OH- + 3SO42- + 6H+
2MnO4- + 7H2O + 3SO32- = 2MnO2 + 6H2O + 3SO42- + 2OH-
2MnO4- + H2O + 3SO32- = 2MnO2 + 3SO42- + 2OH-
В молекулярном виде:
2KMnO4 + H2O + 3Na2SO3 = 2MnO2 + 3Na2SO4 + 2KOH.
3)в щелочной среде:
 |
KMnO4 + Na2SO3 + KOH K2MnO4 + Na2SO4 + H2O
 |
K++(MnO4)-+2Na++(SO3)2- + K+ + OH- 2K+ +(MnO4)2- +2Na+ + +(SO3)2-+H2O
 |
(MnO4)-+(SO3)2-+OH- (MnO4)2- +(SO3)2-+H2O
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
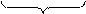
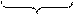

 2 (MnO4)- + 1e = (MnO4)2- процесс восстановления
2 (MnO4)- + 1e = (MnO4)2- процесс восстановления
2 -1 -2
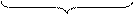
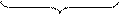 1 (SО3)2- + 2OH- – 2e = (SO4)2- + H2O процесс окисления
1 (SО3)2- + 2OH- – 2e = (SO4)2- + H2O процесс окисления
-4 -2
2(MnO4)- + (SO3)2- + 2OH- = 2(MnO4)2- + (SO3)2- + H2O
В молекулярном виде:
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
|
|
