
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
Институт транспорта
Кафедра ОиСХ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
к контрольным заданиям по дисциплине «Химия»
для студентов нехимических специальностей
заочной формы обучения.
Часть III
Тюмень 2003
Утверждено редакционно-издательским советом
Тюменского государственного нефтегазового университета
Составители: доцент к. х. н. Андрианова Л. И.
доцент к. х. н. Пнёва А. П.
доцент, к. х. н., Обухов В. М.
© Государственное образовательное учреждение высшего профессионального образования
«Тюменский государственный нефтегазовый университет»
2003 г.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
1.1 Cтепень окисленности. Окисление и восстановление
Окислительно-восстановительные реакции – это реакции, в которых изменяется степень окисленности атомов, входящих в состав реагирующих веществ.
Степень окисленности (или окисления) - это тот условный заряд, который приобрел бы элемент, если предположить, что он принял или отдал то или иное число электронов.
Для определения степени окисленности (с.о.) элемента в соединении пользуются следующими правилами:
1) с.о. элемента в простом веществе равна нулю, например, в металле Cu0, или в H20, O20, N20, O30;
2) атомы кислорода в соединениях проявляют с.о. равную -2 (исключение составляют OF2 , где с.о. равно +2, пероксиды, где с.о. равна -1 надпероксиды, где с.о. равна -0.5);
3) для водорода с.о. равна +1 (исключение - гидриды активных металлов, где с. о. равна -1);
4) для фтора с.о. равна -1;
5) во всех соединениях атомы металлов имеют только положительную с.о. При этом металлы главных подгрупп 1, 2, 3 групп имеют постоянную с.о. равную номеру группы;
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
6) алгебраическая сумма с.о. всех атомов в молекуле равна нулю, а в сложном ионе равна заряду иона. Например, определим с.о. серы в H2SO4. С.о. водорода равна +1, с.о. кислорода равна -2, тогда с.о. серы определяется из уравнения: 2(+1)+х+3(-2), отсюда х равно +4.
Таким образом можно определить с.о. элемента в любых соединениях.
Степень окисления иногда не совпадает с валентностью. Валентность определяет число связей, образованных данным атомом, поэтому знака не имеет. Степень окисления имеет знак: плюс или минус, который ставится перед числом. Например, в молекуле аммиака NH3 валентность азота равна 3, а с.о. равна -3, в молекуле метана СН4 валентность углерода равна 4, а с.о. равна -4.
Степень окисления позволяет охарактеризовать химические свойства вещества и определить, будет ли частица отдавать либо принимать электроны.
Если идет переход электронов с орбитали одной частицы на орбиталь другой, то процесс такой называется отдачей электронов или окислением (с.о. повышается). Присоединение электронов, сопровождающееся понижением степени окисления, называется восстановлением.
Частицы, отдающие электроны, называются восстановителями, а частицы, принимающие электроны - окислителями.
Например:
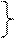 Cl--e = Cl0 2Cl--2e- = Cl2 - процесс окисления
Cl--e = Cl0 2Cl--2e- = Cl2 - процесс окисления
Cl0 +Cl0 = Cl2 восстановитель
Cu 2+ +2e = Cu0 - процесс восстановления
окислитель
В каждой окислительно-восстановительной реакции имеется окислитель и восстановитель. К типичным восстановителям относятся:
1) простые вещества, атомы которых имеют малую электроотрицательность. Например, металлы и многие неметаллы (водород, углерод);
2) отрицательно заряженные ионы неметаллов (S2-, I- , Br-, Cl-, и др.);
3) положитенльно заряженные ионы металлов в низкой степени окисления (Su2+, Fe2+, Cr2+ , Mn2+ , Cu+ и др.).
Окислителями могут быть простые вещества, атомы которых характеризуются высокой электроотрицательностью, например, кислород, катионы и анионы, содержащие атомы с высокой степенью окисления, например Fe3+, Pb4+, Au3+ , NO3- , SO42-, CrO42-. Соединения, содержащие элементы в высшей степени окисления, равной номеру группы, могут быть только окислителями. Соединения, содержащие элементы в низшей степени окисления, равной (№группы –8) (числу электронов, которые атом может присоединить на внешний энергетический уровень), могут быть только восстановителями. Если же вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции, оно может быть и окислителем, и восстановителем. Например, нитрит калия KNO2 , содержащий азот в с.о. равной +3, может как принимать электроны, так и отдавать их, пероксид водорода Н2О2 содержащий кислород в с.о. равной -1, может быть и восстановителем, и окислителем.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. В ходе реакции восстановитель отдает свои электроны, а окислитель принимает. Число отданных электронов должно быть равно числу принятых электронов.
Если окислители и восстановители являются разными веществами, то такие реакции называются межмолекулярными. Например,
0 0 +4 -2
C + O2 = CO2
восстановитель окислитель
Если в реакциях окислитель и восстановитель представляют атомы одной и той же молекулы, то такие реакции называются внутримолекулярными. Например,
-3 +3 0
NH4NO2 = N2 + 2H2O;
+5 -2 -1 0
2KClO3 = 2KCl- + 3O2.
В некоторых реакциях происходит одновременное увеличение и уменьшение степени окисления атомов одного и того же элемента. Такие реакции называют реакциями диспропорционирования (самоокисления, самовосстановления), например:
+6 +7 +4
3K2MnO4 + 2H2O = 2KМnO4 + MnO2 + 4KOH,
+6
где Мп является окислителем и восстановителем.
Характер окислительно-восстановительной реакции зависит от среды, в которой они протекают. Для создания кислой среды используют серную кислоту, а для создания щелочной среды – раствор гидроксида натрия.
|
|
