
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изотерма адсорбции
|
|
В равновесной адсорбционной системе параметры, определяющие равновесие, - это ai парциальные давления р (или с i) и температура Т. Они связаны так называемым термическим уравнением:
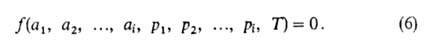
При адсорбции индивидуального адсорбтива (i =1) это уравнение принимает вид:

Три частных случая термического уравнения (когда Т, р или a - константы) играют особую роль в теории адсорбции:
а= 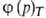 - уравнение изотермы адсорбции,
- уравнение изотермы адсорбции,
Т= 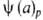 - уравнение изобары адсорбции,
- уравнение изобары адсорбции,
Р- 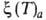 - уравнение изостеры адсорбции.
- уравнение изостеры адсорбции.
В теории адсорбции обычно решается вопрос о виде функции а = 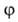 (р)г, т.е. об уравнении изотермы адсорбции. Эта проблема связана с тепловыми эффектами, сопровождающими адсорбцию. При расчете изменения значений основных термодинамических функций в случае перехода dn молей адсорбтива из объемной фазы в поверхностную в равновесной системе при р = const возможны два случая: в первом учитывается только превращение адсорбтива в адсорбат, поскольку адсорбент при адсорбции термодинамически неизменен и его роль - служить источником адсорбционного поля; во втором учитывается и изменение адсорбента.
(р)г, т.е. об уравнении изотермы адсорбции. Эта проблема связана с тепловыми эффектами, сопровождающими адсорбцию. При расчете изменения значений основных термодинамических функций в случае перехода dn молей адсорбтива из объемной фазы в поверхностную в равновесной системе при р = const возможны два случая: в первом учитывается только превращение адсорбтива в адсорбат, поскольку адсорбент при адсорбции термодинамически неизменен и его роль - служить источником адсорбционного поля; во втором учитывается и изменение адсорбента.
Так как система равновесна, то химические потенциалы адсорбата и адсорбтива одинаковы; энтропия адсорбата вследствие уменьшения подвижности молекул при адсорбции меньше энтропии адсорбтива. Поэтому при инертном адсорбенте энтальпия всегда отрицательна, т.е. адсорбция экзотермична. Учет изменения энтропии адсорбента может изменить этот вывод. Например, при сорбции полимерами веществ, в которых полимер набухает, энтропия последнего (из-за увеличения подвижности макромолекул) может столь сильно возрасти, что адсорбция становится эндотермической. В дальнейшем в статье рассматривается только экзотермическая адсорбция.
Различают интегральную, дифференциальную, изостерическую и среднюю теплоты адсорбции.
Интегральная теплота Q равна убыли энтальпии (при V= const - постоянной внутренней энергии) при изменении адсорбции от a1 до а2 (в частном случае может быть а1=0):
Q= -(Н2 - Н1).
Эту величину относят обычно к массе адсорбента и выражают в Дж/кг.
Дифференциальная теплота q (Дж/моль) равна убыли энтальпии dH при изменении а на da. Ее выражают отношением q = — (dH/da). Очевидно, что
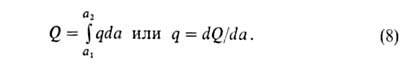
Изостерическую теплоту qst принимают равной:
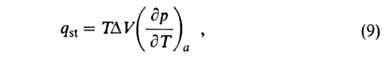
где 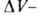 - разность мольных объемов адсорбата и адсорбтива.
- разность мольных объемов адсорбата и адсорбтива.
Вводят также среднюю теплоту Q (Дж/моль):
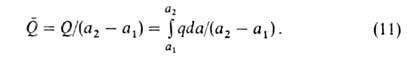
С ростом а параметр Q всегда возрастает, a q может уменьшаться, увеличиваться или оставаться неизменной. С ростом а при неоднородной поверхности адсорбция происходит на все менее активных участках, что приводит к уменьшению q. Однако при этом уменьшаются средние расстояния между адсорбированными молекулами, вследствие чего увеличиваются силы притяжения между ними, и q возрастает. Соотношение между двумя упомянутыми эффектами определяет ход зависимости q=f(a). При очень больших а начинают преобладать силы отталкивания и в этой области q всегда снижается с ростом a.
При очень малых заполнениях поверхности уравнение изотермы адсорбция имеет вид уравнения Генри:
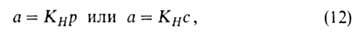
где КH - коэффициент Генри.
Строгая теория изотермы адсорбция была создана И. Ленгмю-ром (1914-18). В основу теории положена след. модель: 1) поверхность адсорбента представляет собой набор энергетически одинаковых активных центров, на которых адсорбируются (локализуются) молекулы адсорбтива; 2) на одном центре адсорбируется только одна молекула, т.е. при адсорбция образуется только один адсорбц. слой (монослой); 3) адсорбция на данном центре не влияет на адсорбция на др. центрах, т. е. взаимод. адсорбированных молекул можно пренебречь.
Модель Ленгмюра наз. локализованной мономолекулярной адсорбция на однородной поверхности. уравнение изотермы адсорбция, соответствующее этой модели, м.б. получено при помощи разл. методов (молекулярно-кинетич., термодинамич., ста-тистико-термодинамич.). Так, адсорбц. равновесие можно выразить след. схемой:
Отсюда получаем уравнение Ленгмюра:
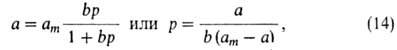
где b -т. наз. адсорбц. коэф., равный Кр-1.
Модель Ленгмюра требует, чтобы дифференц. теплота и энтропия адсорбция не зависели от степени заполнения поверхности.
уравнение (14)-строгое выражение, соответствующее модели Ленгмюра, однако оно редко оправдывается на опыте, поскольку сама модель идеализирована
Введя представление о ф-ции распределения объемов пор по значениям хим. потенциала адсорбата в них, М.М. Дубинин и Л. В. Радушкевич получили уравнение изотермы адсорбции ТОЗМ, которое обычно записывают в след. форме:
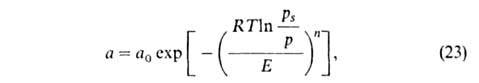
где п, Е и а0-параметры (а0 = а при р = ps). Температурная зависимость a 0:
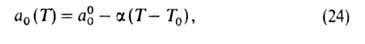
где  = -(da0/dT); a00 = a0 при Т= Т0.
= -(da0/dT); a00 = a0 при Т= Т0.
Каждый микропористый адсорбент характеризуется по ТОЗМ двумя параметрами: W- объемом микропор (W0 = = a0V0)и E0-характеристич. энергией; W0 и E0 относят к стандартному адсорбтиву, обычно к бензолу.
|
|