
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Теоретическое введение. Углерод и кремний находятся в главной подгруппе IV группы
|
|
Углерод и кремний находятся в главной подгруппе IV группы. Их атомы имеют на внешнем уровне 4 электрона (ns2np2), могут проявлять степени окисления от − 4 до +4. Наиболее характерной степенью окисления является +4.
Углерод и кремний при обычных условиях весьма инертны, не растворяются в воде, разбавленных кислотах, вступают в реакцию только с очень энергичными окислителями. При нагревании химическая активность их повышается.
Углерод и кремний образуют оксиды СО, СО2, SiO2. Оксид углерода (II) СО – несолеобразующий оксид. При обычных условиях не взаимодействует ни с кислотами, ни со щелочами, является энергичным восстановителем.
Оксид углерода (IV) СO2 – кислотный оксид, реагирует со щелочами, водой. В водном растворе оксида углерода (IV) устанавливается следующее равновесие:
CO2 + H2O 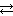 H2CO3
H2CO3 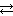 H+ + НСO3‾
H+ + НСO3‾ 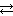 2H+ + CO32‾
2H+ + CO32‾
Н2СO3 – слабая непрочная кислота, существует только в разбавленных растворах. Будучи двухосновной кислотой, угольная кислота образует два ряда солей – карбонаты и гидрокарбонаты. Из карбонатов в воде растворимы только карбонаты щелочных металлов и аммония, гидрокарбонаты растворимы почти все. Оксид углерода (IV) проявляет окислительные свойства при взаимодействии только с очень сильными восстановителями. Например, в его атмосфере горит магний, при этом СО2 восстанавливается до СО или до свободного углерода. В лаборатории СO2 получают в аппарате Киппа по реакции
СаСО3 + 2HCl = СаСl2 + СO2 + Н2O.
Оксид кремния (IV) SiO2 по своему характеру является кислотным оксидом, химически устойчив. С водой SiO2 непосредственно не соединяется. Соответствующая оксиду кремния кремниевая кислота Н2SiO3 может быть получена действием кислот на растворы ее солей. Кремниевая кислота малорастворима в воде. Осадок имеет вид бесцветного студня, причем состав его отвечает не простой формуле H2SiO3, а более общей nSiO2∙ mН2О. Кремниевая кислота очень слабая, ее соли называются силикатами. Из силикатов растворимы только соли щелочных металлов Na2 SiO3 и K2SiO3, называемые растворимым стеклом. Их растворы подвергаются гидролизу и имеют щелочную реакцию:
2K2SiO3 + 2Н2О = K2Si2O5 + 2KOH.
|
|
