
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 2.1.Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях:
|
|
Пример 2.1. Рассчитать эквивалент и молярную массу эквивалентов H2S и NaOH в реакциях:
H2S + 2NaOH = Na2S + 2H2O; (1)
H2S + NaOH = NaHS + H2O. (2)
Решение. Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле
М эк (кислоты, основания) = 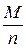 ,
,
где М – молярная масса кислоты или основания; n – для кислот – число атомов водорода, замещенных в данной реакции на металл; для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток.
Значение эквивалента и молярной массы эквивалентов вещества зависит от реакции, в которой это вещество участвует.
В реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае
Э (H2S) = ½ H2S, а М эк (H2S)= 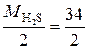 = 17 г/моль.
= 17 г/моль.
В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону 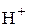 эквивалентна реальная частица – молекула H2S. В этом случае
эквивалентна реальная частица – молекула H2S. В этом случае
Э (H2S) = H2S, а М эк (H2S) = 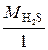 =
= 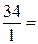 34 г/моль.
34 г/моль.
Эквивалент NaOH в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Молярная масса эквивалентов NaOH равна
М эк (NaOH) = 40 г/моль.
Таким образом, эквивалент H2S в реакции (1) равен ½ H2S, в реакции (2) −
1 H2S, молярные массы эквивалентов H2S равны соответственно 17 (1) и 34 (2) г/моль; эквивалент NaOH в реакциях (1) и (2) равен NaOH, молярная масса эквивалентов основания составляет 40 г/моль.
Пример 2.2. Рассчитать эквивалент и молярную массу эквивалентов оксидов P2O5 и CaO в реакции P2O5 + 3CaO = Ca3(PO4)2.
Решение. Молярная масса эквивалентов оксида рассчитывается по формуле
М эк (оксида) = 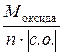 ,
,
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона.
В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4)3-, равен 1/6 P2O5, а М эк (P2O5) = 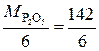 = 23, 7 г/моль. Эквивалент СаО, дающего один двухзарядный катион (Са2+), равен ½ СаО, а М эк (СаО)=
= 23, 7 г/моль. Эквивалент СаО, дающего один двухзарядный катион (Са2+), равен ½ СаО, а М эк (СаО)= 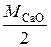 =
= 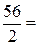 28 г/моль.
28 г/моль.
Пример 2.3. Вычислить эквивалент и молярную массу эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5.
Решение. Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться следующей формулой:
М эк (элемента) =  ,
,
где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента.
Степень окисления фосфора в РН3, Р2О3, Р2О5 соответственно равна –3, +3 и +5. Подставляя эти значения в формулу, находим, что молярная масса эквивалентов фосфора в соединениях РН3 и Р2О3 равна 31/3 = 10, 3 г/моль; в Р2О5 – 31/5 = 6, 2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1/3 Р, в соединении Р2О5 – 1/5 Р.
Пример 2.4. Рассчитать молярную массу эквивалентов соединений фосфора РН3, Р2О3 и Р2О5.
Решение. Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей:
М эк (РН3) = М эк (Р) + М эк (Н) = 10, 3 + 1 = 11 г/моль;
М эк (Р2О3) = М эк (Р) + М эк (О) = 10, 3 + 8 = 18, 3 г/моль;
М эк (Р2О5) = М эк (Р) + М эк (О) = 6, 2 + 8 = 14, 2 г/моль.
Пример 2.5. На восстановление 7, 09 г оксида металла со степенью окисления +2 требуется 2, 24 л водорода при нормальных условиях. Вычислить молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла?
Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться следующей формулой:
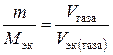 ,
,
где V эк (газа) – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ) в одном моле газа: υ = 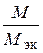 . Так, М (Н2) = 2 г/моль; М эк (Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н.у.) (Т = 273 К, Р = 101, 325 кПа) занимает объем 22, 4 л. Значит, моль водорода займет объем 22, 4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен V эк (Н2) = 22, 4/2 = 11, 2 л. Аналогично М (О2) = 32 г/моль, М эк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32/8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода при нормальных условиях занимает объем V эк (О2) = 22, 4/4 = 5, 6 л.
. Так, М (Н2) = 2 г/моль; М эк (Н2) = 1 г/моль. Следовательно, в одном моле молекул водорода Н2 содержится υ = 2/1 = 2 моль эквивалентов водорода. Как известно, моль любого газа при нормальных условиях (н.у.) (Т = 273 К, Р = 101, 325 кПа) занимает объем 22, 4 л. Значит, моль водорода займет объем 22, 4 л, а так как в одном моле водорода содержится 2 моль эквивалентов водорода, то объем одного моля эквивалентов водорода равен V эк (Н2) = 22, 4/2 = 11, 2 л. Аналогично М (О2) = 32 г/моль, М эк (О2) = 8 г/моль. В одном моле молекул кислорода О2 содержится υ = 32/8 = 4 моль эквивалентов кислорода. Один моль эквивалентов кислорода при нормальных условиях занимает объем V эк (О2) = 22, 4/4 = 5, 6 л.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Подставив в формулу 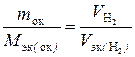 численные значения, находим, что М эк (оксида) =
численные значения, находим, что М эк (оксида) = 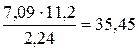 г/моль.
г/моль.
Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение металла с кислородом, поэтому молярная масса эквивалентов оксида представляет собой сумму М эк (оксида) = М эк (металла) + М эк (кислорода). Отсюда М эк (металла) = М эк (оксида) − М эк (кислорода) = 35, 45 – 8 = 27, 45 г/моль.
Молярная масса эквивалентов элемента (М эк) связана с атомной массой элемента (М А) соотношением: М эк (элемента) =  , где ½ с.о. ½ − степень окисления элемента. Отсюда М А = М эк (металла) ∙ ½ с.о. ½ = 27, 45× 2 = 54, 9 г/моль.
, где ½ с.о. ½ − степень окисления элемента. Отсюда М А = М эк (металла) ∙ ½ с.о. ½ = 27, 45× 2 = 54, 9 г/моль.
Таким образом, М эк (оксида) = 35, 45 г/моль; М эк (металла) = 27, 45 г/моль; М А (металла) = 54, 9 г/моль.
Пример 2.6. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитать объемы газов, вступивших в реакцию при нормальных условиях.
Решение. По закону эквивалентов число молей эквивалентов веществ, вступающих в реакцию и образующихся в результате реакции, равны между собой, т.е. υ (О2) = υ (N2) = υ (NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2.
Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2), и так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому
М эк (N2) = 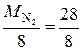 = 3, 5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): 28 г/моль N2 – 22, 4 л
= 3, 5 г/моль. Находим объем, занимаемый молем эквивалентов азота (IV): 28 г/моль N2 – 22, 4 л
3, 5 г/моль N2 – х
х = 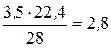 л.
л.
Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V (N2) = 2, 8·4 = 11, 2 л. Зная, что моль эквивалентов кислорода при нормальных условиях занимает объем 5, 6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V (O2) = 5, 6∙ 4 = 22, 4 л.
Итак, в реакцию вступило 11, 2 л азота и 22, 4 л кислорода.
Пример 2.7. Определить молярную массу эквивалентов металла, если из 48, 15 г его оксида получено 88, 65 г его нитрата.
Решение. Учитывая, что М эк (оксида) = М эк (металла) + М эк (кислорода), а М эк (соли) = М эк (металла) + М эк (кислотного остатка), подставляем соответствующие данные в закон эквивалентов:
 ;
;
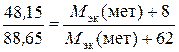 ,
,
отсюда М эк (металла) = 56, 2 г/моль.
Пример 2.8. Вычислить степень окисления хрома в оксиде, содержащем 68, 42 % (масс.) этого металла.
Решение. Приняв массу оксида за 100 %, находим массовую долю кислорода в оксиде: 100 – 68, 42 = 31, 58 %, т.е. на 68, 42 частей массы хрома приходится 31, 58 частей массы кислорода, или на 68, 42 г хрома приходится 31, 58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов:
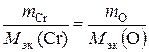 ; М эк (Cr) =
; М эк (Cr) = 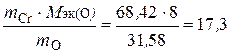 г/моль.
г/моль.
Степень окисления хрома находим из соотношения 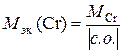 ,
,
отсюда | c. o. | = 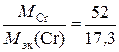 = 3.
= 3.
|
|
