
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определить в зависимости от степеней свободы.
|
|
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоемкость идеального газа с i степенями свободы при постоянном объеме равна:
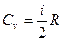

R = 8.31Дж/(моль К) — универсальная газовая постоянная.
А при постоянном давлении
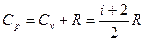
Исходя из теоремы о равнораспределении энергии по степеням свободы, каждая доступная степень свободы увеличивает молярную теплоемкость на R/2. Некоторые из этих степеней свободы (а именно, поступательное движение молекул) воспринимается нами как температура, иные - не воспринимаются явно никак. Поэтому чем больше степеней свободы, тем больше теплоемкость. Для многоатомной молекулы есть несколько типов степеней свободы, несколько типов движений, в которых она принимает участие. Во-первых, это 3 поступательных степени свободы. Во-вторых, это вращение молекулы. В-третьих, это колебания отдельных атомов в молекуле друг относительно друга. В-четвертых, это возбуждения электронных оболочек. Из-за того, что молекулы " живут" в квантовом мире, их вращение, колебания и т.д. существуют не всегда, а лишь при достаточно высоких температурах. Например, вращение молекулы не может происходить с произвольно малой угловой скоростью, а возможно лишь при неких определенных ее значениях. Поэтому энергия вращения имеет некое минимальное значение. И если температура достаточно мала, то никакие столкновения не смогут завращать молекулы. Аналогичная картина имеет место и для остальных степеней свободы. Так что в результате получается следующее: при очень малых температурах каждая молекула газа имеет лишь три поступательных степени свободы, и теплоемкость CV газа равна 1, 5 R. При повышении температуры " включаются" вращательные степени свободы. Это включение происходит не сразу, а постепенно, так что теплоемкость тоже растет, но не скачком. Интересно отметить, что аккуратный расчет предсказывает, что теплоемкость как функция температуры будет иметь небольшой максимум.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
То происходит с теплоемкостью при еще более высоких температурах? Там, во-первых, вступают в игру уже и электронные степени свободы, и, кроме того, начинается диссоциация молекул на атомы или ионы. Все это, казалось бы, должно приводить к дальнейшему росту теплоемкости. Однако не исключено, что на промежуточном этапе теплоемкость может проходить через экстремумы. Забудем на время про электронные степени свободы, оставим только возможность диссоциации молекулы на два атома при высоких температурах. Тогда до диссоциации, но уже при полностью включенных вращательных и колебательных степенях свободы, мы имеем 7 степеней свободы (3+2+2) на 1 молекулу (то есть на два атома). После диссоциации у нас вместо молекулы появились 2 отдельных атома. Число степеней свободы теперь равно 6. Из-за этого теплоемкость CV одного моля первоначального газа после диссоциации уменьшается с 3, 5R до 3R, то есть эта теплоемкость проходит через максимум. Теплоемкость CP возрастает с 4, 5R до 5R, то есть максимума не имеет (заметьте, что после диссоциации CP отличается от CV уже на 2R, так как число молей в системе возросло в два раза).

|
|
