
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема Х
|
|
Литературный обзор Схемы и литература
Триптамин 1 был впервые получен Эвинсом и Лайдло [1] более ста лет назад. Однако широкий интерес химиков производные триптамина привлекли только после открытия серотонина в 1949 году, как потенциальные аналоги данного нейромедиатора. Дальнейшие исследования показали что новые производные триптаминов проявляют широкий спектр биологической активности.
Первый синтез триптамина был осуществлен путем воздействия гнилостных бактерий на триптофан 2. Позднее [2], с развитием биотехнологий, когда стало возможным выделение ферментов в чистом виде, было показано, что данная реакция протекает под действием декарбоксилазы L-аминокислот.
Схема 1.

Недавно Макмиланом был разработан метод синтеза триптаминов с заместителями в этиленовом фрагменте из триптофана с использованием фотокаталитического подхода. Стоит отметить, что данный метод ограничен образованием незамещенных в индольном фрагменте триптаминов, поскольку производные триптофана недоступны.
Схема Х

В настоящее время к синтезу аналогов триптамина существует множество подходов. Для удобства рассмотрения их все можно разделить на два типа: модификации индола и его производных, а также методы, предполагающие одновременное формирование индольного цикла и этиленового фрагмента (рис. 1). Среди последних стоит выделить методы, основаные на модификациях синтеза Фишера.
Рисунок 1.
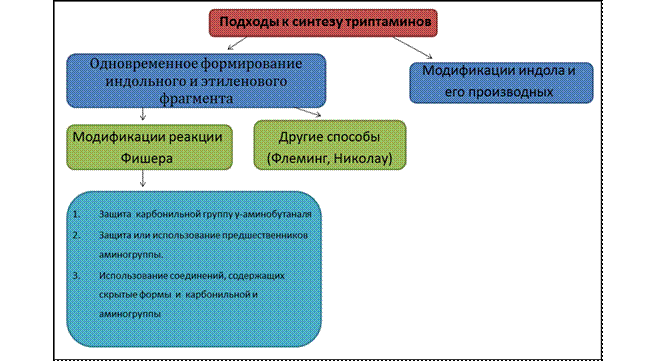
2.1 Модификации индола и его производных
Данный подход заключается в формировании этиленового фрагмента путем модификации индола и его производных. Существует, например, метод прямого аминоэтилирования индолилмагний иодида 3 хлораминами 4 [3], однако выход триптаминов 5 в этом случае оказывается крайне низким.
Схема 2.

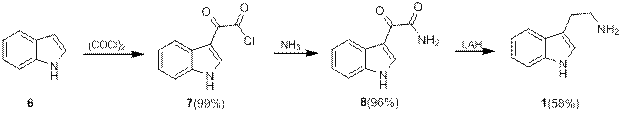
При действии оксалилхлорида на индол 6 с высоким выходом образуется индолглиоксилхлорид 7, который далее превращается в амид 8, восстановление которого дает триптамин.
Схема 3.
В последствии этот метод был использован для синтеза триптаминов 9 из индола 10, содержащих изотопную метку 15N в индоле (схема 4). Данные соединения были интересны с точки зрения изучения продуктов их метаболизма в живых организмах [4]. Так как источником этиленового фрагмента в данной реакции является оксалилхлорид, введение заместителей в боковую цепь представляется затруднительным.
Схема 4.

Синтез триптаминов с участием галогенной функции возможен и путем ацилирования индола α -галогенкарбонилхлоридами. Действие азида натрия на галогенацилиндолы 11 приводит к образованию азидов 12, которые далее превращаются в триптамины 13 восстановлением алюмогидридом лития [5]. Данная реакция является хорошим методом введения заместителя в альфа положение боковой цепи триптамина. В оригинальной работе в качестве заместителя были взяты R = Ph, Me, Et.
Схема 5.

Предшественниками триптаминов могут быть также соответствующие нитропроизводные. Например, 3-(2-нитроэтил)индолы 14 образуются при взаимодействии грамина 15 с нитроалканами в присутствии щелочи, причем данный метод позволяет вводить заместитель в этиленовый фрагмент триптамина [6]. Но в литературе найдены примеры введения только ограниченного круга заместителей R = Ph, Me, COOEt Аналогичные нитропроизводные 14 образуются и при алкилировании индола 15 ацетоксинитроэтаном [7]. Также [8], при взаимодействии индола 273 или индолилмагнийиодида 3 с нитроэтиленом получается (нитроэтил)индол 14 (в обоих случаях с невысокими выходами). При этом в случае алкилирования индола ацетатом нитрогруппа яляется защищенной формой аминогруппы, в то время как в остальных случаях акцепторные свойства нитрогруппы являются принципиальными для возможности протекания реакции. Во всех случаях каталитическое гидрирование приводило к образованию производных триптамина 17 (схема 1.91).
Схема 6.

При синтезе серотонина (и его близких аналогов) Юнг использовал (2-нитровинил)индол 18, который легко получается по реакции формилиндола 19 с нитрометаном (схема 1.92). Восстановление его с помощью LiAlH4 привело к образованию триптамина 20, а дальнейшее каталитическое гидрирование и последующая обработка креатинин-сульфатом дали серотонин 21 в виде креатинин-сульфатного комплекса[9].
Схема 7.

Также хорошим методом синтеза триптаминов, путем введения этиленового фрагмента в индол являетсят гидроксиэтилировнаие индола путем литирования с последующим взаимодействием с оксидами алкенов. Данный метод позволяет проводить реакцию стереоселективно.
|
|