
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. 1.В процессе нейтрализации протекает следующая химическая реакция:
|
|
1.В процессе нейтрализации протекает следующая химическая реакция:
НСООН+КОН=НСООК+Н2О
НСООН+ОН-=НСОО-+Н2О
2.В момент, когда нейтрализовано 90% муравьиной кислоты, в растворе присутствуют следующие компоненты: муравьиная кислота НСООН, ее соль НСООК и вода.
Поскольку данная смесь представляет собою буферный раствор, содержащий слабую кислоту НСООН и ее соль НСООК, рассчитаем рН раствора по формуле:
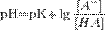 ,
,
где рК- отрицательный десятичный логарифм от константы диссоциации слабой кислоты, [А-]- молярная концентрация образовавшейся соли, [НА]- молярная концентрация непрореагировавшей кислоты.
Кд(НСООН)= 4, 6*10-4, рК=3, 75.
2.1Найдем концентрацию образовавшейся соли:
Согласно уравнению реакции
n(образовавшейсяНСООК)= n(прореагировшей НСООН)=0, 9*С(НСООН)*V(НСООН), где 0, 9- доля нейтрализованной кислоты, С(НСООН)-ее концентрация, V(НСООН) – объем раствора НСООН, л
[НСОО-]= n(образовавшейсяНСООК)/V(полученного раствора)
V(полученного раствора)= V(НСООН)+ V(КОН, затраченный на нейтрализацию 90% кислоты.)
Так как концентрации кислот ы и щелочи одинаковые, то, согласно закону эквивалентов
V(КОН, затраченный на нейтрализацию 90% кислоты)=0, 9* V(НСООН)
Т.о. V(полученного раствора)= V(НСООН)+ 0, 9* V(НСООН)=1, 9* V(НСООН)
Тогда [НСОО-]= n(образовавшейсяНСООК)/V(полученного раствора)= 0, 9*С(НСООН)*V(НСООН)/ 1, 9* V(НСООН)=0, 9*0, 05/1, 9=0, 023684 моль/л
2.2.Найдем концентрацию оставшейся кислоты:
[НСООН]= n(оставшейсяНСООН)/V(полученного раствора)=0, 1*С(НСООН)*V(НСООН)/1, 9* V(НСООН)=0, 1*0, 05/1, 9=0, 002632
Найдем рН раствора:
рН =рК+lg([НСОО-]/ НСООН])=3, 75+ lg(0, 023684 / 0, 002632)=4, 7
3.В момент, когда нейтрализовано 100% муравьиной кислоты, в растворе присутствуют соль НСООК и вода. Поскольку данная смесь представляет собою раствор, содержащий гидролизующуюся по аниону соль слабой кислоты НСООН и сильного основания КОН, рассчитаем рН раствора по формуле:

,
где рК- отрицательный десятичный логарифм от константы диссоциации НСООН, [НСОО-]- молярная концентрация образовавшейся соли.
Кд(НСООН)= 4, 6*10-4, рК=3, 75.
3.1.Найдем концентрацию образовавшейся соли:
Согласно уравнению реакции
n(образовавшейсяНСООК)= n(прореагировшей НСООН)=1*С(НСООН)*V(НСООН), где 1- доля нейтрализованной кислоты, С(НСООН)-ее концентрация, V(НСООН) – объем раствора НСООН, л
[НСОО-]= n(образовавшейсяНСООК)/V(полученного раствора)
V(полученного раствора)= V(НСООН)+ V(КОН, затраченный на нейтрализацию 100% кислоты.)
Так как концентрации кислот ы и щелочи одинаковые, то, согласно закону эквивалентов
V(КОН, затраченный на нейтрализацию 100% кислоты)=1* V(НСООН)
Т.о. V(полученного раствора)= V(НСООН)+ 1* V(НСООН)=2* V(НСООН)
Тогда [НСОО-]= n(образовавшейсяНСООК)/V(полученного раствора)= С(НСООН)*V(НСООН)/ 2 V(НСООН)= 0, 05/2=0, 025 моль/л
3.2. Найдем рН раствора:
рН =7+0, 5рК+0, 5lg[НСОО-] =7+ 0, 5*3, 75+ 0, 5*lg 0, 025 =8, 07
4.В момент, когда нейтрализовано 110% муравьиной кислоты, в растворе присутствуют гидролизующаяся соль НСООК и сильный электролит КОН. Поскольку основной вклад в кислотно-основное равновесие водного раствора вносит сильный электролит, рассчитаем рН раствора по формуле:
рН= 14+lg[ОН-],
где[ОН-] – концентрация щелочи в полученной растворе.
Рассчитаем величину [ОН-]:
[ОН-]= n(избыточной КОН)/V(полученного раствора)
n(избыточной КОН)=0, 1* С(НСООН)*V(НСООН)=0, 1*0, 05* V(НСООН)=0, 005* V(НСООН)
V(полученного раствора)= V(НСООН)+ V(КОН, затраченный на нейтрализацию 110% кислоты.) Так как концентрации кислоты и щелочи одинаковые, то, согласно закону эквивалентов
V(КОН, затраченный на нейтрализацию 110% кислоты)=1, 1* V(НСООН)
Т.о. V(полученного раствора)= V(НСООН)+ 1, 1* V(НСООН)=2, 1* V(НСООН)
Тогда [ОН-]= n(избыточной КОН)/V(полученного раствора)= 0, 005* V(НСООН)/ 2, 1* V(НСООН)=0, 005/2, 1=0, 002381 моль/л
рН= 14+lg[ОН-]=14+lg0, 002381=11, 38.
Ответ: В момент нейтрализации 90% кислоты рН = 4, 7, в момент нейтрализации 100 % кислоты рН=8, 07, в момент нейтрализации 110 % кислоты рН=11, 38.
_________________________________________________________________________________----
40. Для стандартизации раствора перманганата калия навеску оксалата натрия массой 1, 3444 г растворили в мерной колбе объемом 200 мл. На титрование 20 мл полученного раствора затратили 20, 04 мл раствора КМnО4. Рассчитать:
А) молярную концентрацию эквивалента КМnО4
Б)титр КМnО4
В) титр раствора КМnО4 по Nа2С2О4
Г) поправочный коэффициент раствора КМnО4
|
|