
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 1. Последов ателье ость атшгоа ври биохимических исследованиях Эош ассмюив» 06wt ятоаедоюм 3 страница
|
|
В 1902 г. Фишер я Гофмейстер предложили пептидную теорию строения белка. В это же время Фишер с сотр. скнтезировал в лаборатории первые пептиды.
В 1925—1930 гг. Сведберг сконструировал ультра центрифугу и использовал ее для определения молекулярной массы выдваяемых белков.
В 1951 г. Полннг и Кори разработали модэль вторичной структуры белка, названной а^спиралью. В 1952 г. Лиидерстрём-Ланг предположил существование трех уровней организации белковой молекулы: первичный, вторичный, третичный.
В 1953 г. Сенгер впервые расшифровал последовательность аминокнелот в инсулине. В 1956 г. Мур, и Стейн создали первый автоматический анализатор аминокислот. В 1958 г. Кендрыо и в 1959 г. Перутц расшифровали трехмерные структуры белков — миоглобиид и гемоглобине. В 1963 г. Цан синтезировал природный белок инсулин.
Содержание и распределение белков в организме
Белки составляют значительную часть тканей живого организма: до 25% сырой и до 45—50% сухой массы. В растениях белка значительно меньше, но даже небольшое количество белков в некоторых клетках ие говорит о том, что их роль в жизнедеятельности невелика
Распределение белков между- субклеточными структурами неравномерно: больше всего их в клеточном соке (гиалоплазме). Содержание бвлков в органел- лах определяется скорее размерами и количеством органелл в клетке. 24
Примерное распределение беяка (в % от общего белка клетки) в субклеточных фракциях нлеток печени
Ядро................................ 12.0
Митохондрии................. 20, 0
Лнэосомы.......................... 2, 0
Мнкросомы..................... 20, 0
Пероксисомы.................... 2, 5
Плазматическая мембрана 1, 5
Гнелоплаэма (внутриклеточный сок) 40
Прочие частицы................. 2, 0
Белок и его характерные признаки
Белками называются высокомолекулярные азотсодержащие органические вещества, состоящие из аминокислот, соединенных в цепи с помощью пептидных связей, и имеющие сложную структурную организацию.
Это определение объединяет характерные признаки белков, среди которых можно выделить следующие:
1) довольно постоянная доля азота (в среднем 16% от сухой массы);
2) наличие постоянных структурных звеньев — аминокислот;
3) пептидные связи между аминокислотами, с помощью которых они соединяются в полипептидные цепи;
4) большая молекулярная масса (от 4—5 тысяч до нескольких миллионов дальтонов);
5) сложная структурная организация полипептидной цепи, определяющая физико-химические и биологические свойства белков.
Элементные состав белков. Первый признак вытекает нэ элементного состава белков (в % от сухой массы белка):
Углерод...... 51—55 Водород... 6—7
Кнслород... 21—23 Сера.......... 0, 3—2, 5
Азот............ 15—18 Зола.......... 0—0, 5
В среднем для большинства белков растительного, животного и микробного происхождения доля азота в отличие от других элементов довольно постоянна— примерно 16%; на основании этого признака рассчитывают количество белка: массу азота, найденную при анализе, умножают на коэффициент.6, 25 (100: 16 = 6, 25). Но для некоторых белков этот признак нетипичен. Например, в протаминах содержание азота достигает 30%, поэтому толькотзо элементному составу нельзя точно отличить белок от других азотсодержащих веществ организма.
Структурные звенья, или мономеры, белков можно обнаружить после кислотного гидролиза. Этот прием наиболее часто используют для изучения состава белков. Мономерами белков являются а-аминокислоты L-ряда. Соединяются аминокислоты в цепь ковалентными пептидными связями.
Молекулярная масса белков. Важнейшим признаком белков является большая молекулярная масса. В зависимости от длины цепи все полипептиды условно можно разделить на пептиды (содержат от 2 до 10 аминокислот) полипептиды (от 10 до 40 аминокислот) и белки (свыше 40 аминокислот). Если принять среднюю молекулярную массу одной аминокислоты около 100, то молекулярная масса пептидов приближается к 1000, полипептидов — до
4000, а белков — от 4—5 тыс. до нескольких миллионов. Ниже приводится молекулярная масса некоторых белков.
Инсулин
гшсулин Рнбонуклеаза Трипсин...
4000 Церуллоплаэиин..
6000 Фибриноген...
13 700 Глугаматдегндрогенааа
| 160 000 341 000 1 000 000 9 000 000 |
23 800 Гемоцианиы улитки.
Сложная структурная организация белков. Некоторые природные полипептиды (состоящие, как правило, из одной аминокислоты) и искусственно полученные полипептиды имеют большую молекулярную массу, но отнести их к белкам нельзя. Отличить их от белков помогает такой уникальный признак, как способность белков к денатурации, т. е. потеря характерных физико-хими- ческих свойств и, главное, биологических функций, при действии нещешь, не разрывающих пептидные связи. Способность к денатурации свидетельствует о сложной пространственной организации белковой молекулы, отсутствующей у обычных полипептидов.
2. Аминокислоты — структурные мономеры белков
Аминокислотами называются -органические карбоЫовые кислоты, у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу. В зависимости от положения группы —NH2 различают а, р, у и т. д. L-аминокислоты. К настоящему времени в различных объектах живого мира найдено до 200 различных аминокислот. В организме человека содержится около 60 различных аминокислот и их производных/но не все они входят в состав белков.
Аминокислоты делятся на две группы: протеиногенные (входящие в состав белков) и непротеиногенные (не участвующие в образовании белков).
Среди протеиногенных аминокислот выделяют главные (их всего 20) и редкие. Редкие белковые аминокислоты (например, гидроксипролин, гидрокснли- зин, амииолимонная кислота и- др.) на самом деле являются производными тех же 20 аминокислот.
Остальные аминокислоты не участвуют в построении белков; они находятся в клетке либо в свободном виде (как продукты обмена), либо входят в состав других небелковых соединений. Например, аминокислоты орнитин и цитруллин являются промежуточными продуктами в образовании протеиноген- ной аминокислоты аргинина и участвуют в цикле синтеза мочевины; 7" амин0" масляная кислота тоже находится в свободном виде и играет роль медиатора в передаче нервных импульсов; р-аланин входит в состав витамина — пантоте- новой кислоты.
Непротеиногенные аминокислоты в отличие от протеиногенных более разнообразны, особенно те, которые содержатся в грибах, высших растениях. Протеиногенные аминокислоты участвуют в построении множества разных белков независимо от вида организма, а непротеиногенные аминокислоты могут быть даже токсичны для организма другого вида, т. е. ведут себя как обычные чужеродные вещества. Например, канаваннн, дьенколевая кислота и р-цнано- аланин, выделенные из растений, ядовиты для человека.
Строение и классификация протеиногенных аминокислот
Все аминокислоты белков относятся к L-аминокислотам, содержащим аминогруппу — NH2 в а-положении:
R—СН—СООН
I
NH2
Радикал R в простейшем случае представлен атомом водорода (глицин), а может иметь и сложное строение. Поэтому а-аминокислоты отличаются друг от друга прежде всего строением бокового радикала, а следовательно, и физико- химическими свойствами, присущими этим радикалам.
Приняты три классификации аминокислот:
1) структурная, т. е. по строению бокового радикала (см. табл. 5);
2) электрохимическая, т. е. по кислотно-основным свойствам аминокислот;
3) биологическая, или физиологическая, т, е. по степени незаменимости аминокислот для организма.
По электрохимическим (или кислотно-основным) свойствам'аминокислоты делятся на три группы в зависимости от физико-химических свойств бокового радикала: кислые, основные и нейтральные.
К. кислым аминокислотам относятся аминокислоты с дополнительными карбоксильными группами в боковом радикале, которые обеспечивают кислые свойства этой группы аминокислот: аспарагиновая, глутаминовая, амино- лимонная кислоты. Некоторые авторы считают, что у тирозина и цистеииа гидроксильная и сульфгидрильная группы в боковом радикале обладают слабовыраженными кислыми свойствами.
К основным аминокислотам, относятся лизнн, аргинин и гнетидин, т. е. аминокислоты, имеющие дополнительную группировку, соответственно аминогруппу, гуанидиновую или имидазольную, что придает им основные свойства.
Нейтральные аминокислоты — это все остальные аминокислоты. У них боковой радиквл не проявляет ни кислых, ни основных свойств.
Таблица 5. Классификация аминокислот
I. Ациклические
Продолжение табл. 5
|
Гидроксиаминокислоты
Сернн (а-ацнио-р-гндроксипропн-
Треонин (а-амино-0-гнАроксимас- ляяая кислота)
б. Тиоаяинокислоты
Цистеин (а-а
Ч ^о
IS-CH, 4C-C
I I ^он
пК»
i INHj
| I NH, но—с: |
| Н | NH, V-W-cf° |
< 1н
Продолжение табл. 5
|
| '. Карбоксиаминокислоты (моноаминодикарбоноаые кислоты) |
| I
сн, 4с—сГ
ВО^ I > он
С—СН2—CHj-1-C—с^ 'I I " -он
о^ I I ^Z—CHi-f-C—CC^
| " " он
о 1 NHs
Н, ëà I |
ДаоминокиСА огы (диаминамонокирбоновые кислоты)
| Лизин (а, г-диамнноклп ромовая |
| 1 1 .—CH2-f-C—С |
H, N—СН, — CHS—СН, —CH2-f-i
NHj-C-NH-CHj-CHj-CHj^-d-cf^ У М
NH | Й
юаминокислоты
Аргинин (а-а иино-в-гуан иди нова- лерианован кислота)
Продолжение табл. S
II. Циклические аминокислоты
1. Ароцатич
L, „
. 0-CH-l{-< „ lH
jNH,
но- < f~Ч-сн^-с^
2. Гетероиикличе)NHa
Oi-ll-c
н
[ NH2
N- п -енЛ^-С*" 0
U 'А
Н2С,.СН*
Hjck[^7cH—Соон
Пролин (пирролндин-а-клрбоно- вая кислота)
НО—НС. |CHjj
Н—COO Н
I Гидр оке и пролин (у-тидроксипир- ролндин-а-карбоновая кислота)
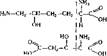
Продолжение табл. 5
R-rpynna
|
| 14 ноос I н |
| ноос |
Гидроисилнз'лн (а.е-диамино-^- гндрооксикапроновая кислота)
Аминолимонная (а-амино-р-гид- р оксн-0 - карб оке и гл ута р овая)
В зависимости от полярности радикала аминокислоты первых двух групп (кислые и основные) относятся к полярным, а аминокислоты третьей группы (нейтральные) — к неполярным, или гидрофобным.
По биологическому, или физиологическому, значению аминокислоты также подразделяются на три группы: незаменимые, полузаменимые н заменимые.
Незаменимые аминокислоты не могут синтезироваться организмом из других соединений, поэтому они обязательно должны поступать извне (с пищей). Абсолютно незаменимых аминокислот для человека восемь: из алифатических незамещенных — валин, лейцин, изолейцин; из алифатических замещенных — треонин, лнзин, метионин, из ароматических — фенилалании; из гетероциклических — триптофан.
Полузаменцмые аминокислоты образуются в организме, но в недостаточном количестве, поэтому частичнр должны поступать с пищей. Для организма человеха такими аминокислотами являются аргинин, тирозин, гистидин.
Заменимые аминокислоты синтезируются в организме в достаточных количествах из незаменимых аминокислот или других соединений. Организм может обходиться без них долгое время, если, конечно, с пищей поступают вещества, из которых эти аминокислоты могут быть синтезированы. К заменимым аминокислотам относятся остальные аминокислоты.
Приведенная физиологическая классификация аминокислот не универсальна в отличие от первых двух классификаций и до некоторой степени условна, поскольку'действительна только для организмов данного вида. Однако абсолютная незаменимость восьми аминокислот универсальна для всех видов организмов (в табл. 6 приведены данные для некоторых представителей позвоночных и насекомых). Для крыс и мышей незаменимых аминокислот уже девять (к восьми известным добавляется гистидин). Нормальный рост и развитие курицы возможны только при наличии одиннадцати незаменимых аминокислот (добавляются гистидин, аргинин, " тирозин), т. е. полузаменимые для человека аминокислоты абсолютно незаменимы для курицы. Для москитов глицин является абсолютно незаменимой, а тирозин, наоборот, заменимой аминокислотой.
Значит, для разных видов организмов возможны существенные отклонении в потребности в отдельных аминокислотах, что определяется особенностями их обмена.
Сложившийся для каждого вида организма состав незаменимых амино-
Таблица 6. Незаменимые (+) н заменимые (—) аминокислоты для некоторых: позвоночных и насекомых (по Любке и др.. 1075)
|
| * ± — Полуэапенимые аминокислоты. |
кислот, или так называемая ауксотрофность организма в отношении аминокислот, отражает скорее всего стремление его к минимальным энергетическим затратам на синтез аминокислот. Действительно, выгоднее получать готовый продукт, чем производить его самому. Поэтому организмы, потребляющие незаменимые аминокислоты, тратят примерно на 20% энергии меньше, чем те, которые синтезируют все аминокислоты. С другой стороны, в ходе эволюции не сохранилось таких форм жизни; которые бы полностью зависели от поступления всех аминокислот извне. Им трудно было бы приспосабливаться к изменениям внешней среды, учитывая, что аминокислоты являются" материалом для синтеза такого вещества, как белок, без которого жизнь невозможна.
Физико-химические свойства аминокислот
Кислотно-основные свойства аминокислот. По химическим свойствам аминокислоты — амфотерные электролиты, т. е. сочетают свойства и кислот, и оснований. Кислотные группы аминокислот: карбоксильная (—СООН-*- -*■ —СОО~ + Н+), протонированная а-аминогруппа {—NH? -*-—NH2+ Н+).
Основные группы аминокислот: диссоциированная Карбоксильная (— СОО" +Н+-*— СООН) и а-аминогруппа f—-NHj + H+-»-NH|").
Для каждой аминокислоты R—СН—СООН имеется как минимум две
rta'
константы кислотной диссоциации р/(*— одна для группы —СООН, а вторая •для а-аминогруппы.
В водном растворе возможно существование трех форм аминокислот:
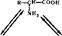
|
| r—< j: H—coo" r—сн—соон |
| X/ R—< j! H—COO |
ДдКвзано, что в водных растворах аминокислоты находятся в виде диполя; или цвиттер-иона.
Влияние рН среды на ионизацию аминокислот. Изменение рН среды от кислой до щелочной влияет на заряд растворенных аминокислот. В кислой среде (рН< 7) все аминокислоты иесут положительный заряд (существуют в виде катиона), - так как избыток протонов в среде подавляет диссоциацию карбоксильной группы:
r—сн—coo" —сн—соон ' '
'!!
nhs* nhj
В кислой среде аминокислоты в электрическом поле движутся к катоду. В щелочной среде (рН> 7), где имеется избыток ионов ОН" аминокислоты находятся в виде отрицательно заряженных ионов (анионов), так как диссоциирует NHyrpynna-.
r_ch—coo- + он--» r— сн—coo- + hjo
I I'
lIlHf NH,
В этом случае аминокислоты перемещаются в электрическом поле к анбду.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд.
Состояние, в 'котором заряд аминокислоты равен нулю, называется изо- электрическим. Значение рН, при'котором наступает такое состояние и аминокислота ие перемещается в электрическом поле ни к аноду, ни к катоду, называется изоэлектрической точкой и обозначается рНь Изоэлектрическа» точка очень точно отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
Изоэлектрическая точка неполярных (гидрофобных) аминокислот приближается к нейтральному значению рН (от 5, 5 для феннлаланина до 6, 3 для пролина), у кислых она имеет низкие значения (для глутаминовой кислоты 3, 2, для аспарагиновой 2, 8). Изоэлектрическая точка для цистеина и цистина равна 5, 0, что указывает на слабые " кислотные свойства этих аминокислот.
У основных аминокислот — гисгидина и особенно лизина н аргинина — изоэлектрическая точка значительно выше 7.
В клетках и межклеточной жидкости организма человека и животных рН среды близка к нейтральной, поэтому основные аминокислоты- (лизин, аргинин) несут суммарный положительный заряд (катионы), кислые аминокислоты (аспарагиновая и глутам-иновая) имеют отрицательный заряд (анионы), а остальные существуют в виде диполя. Кислые и основные аминокислоты больик гидратированы, чем все остальные аминокислоты.
Стереонзомерия аминокислот
Все протеиногенные аминокислоты, за исключением глицина, имеют как минимум один асимметрический атом углерода (С*) и обладают оптической активностью; причем большая часть их относится к левовращающим. Они существуют в виде пространственных изомеров, или сгереоизомеров. По расположению заместителей вокруг асимметрического атома углерода стерео- изомеры относят к L- или D-ряДу.
L- и D-изомеры относятся друг к другу как предмет и его зеркальное изображение, поэтому их называют также зеркальными изомерами или энантиоме- рами. Аминокислоты треонин и изолейцин имеют по два асимметрических атома углерода, поэтому у них по четыре стереоизомера. Например, у треонина, помимо L- и D-треонина, имеется еще два, которые называют диастереомера- ми или аллоформами: L-аллотреонин и D-аллотреонин.
Все аминокислоты, входящие в состав белков, относятся к L-ряду. Считалось, что D-аминокислоты не встречаются в живой природе. Однако были найдены полипептиды в виде полимеров D-глутаминовой кислоты в капсулах спороносных бактерий (палочке сибирской язвы, картофельной и сенной палочке); D-глутаминовая кислота и D-аланин входят в состав мукопептндов клеточной стенки некоторых бактерий.. D-Амивокислоты обнаружены также в антибиотиках, продуцируемых микроорганизмами (см. табл. 7).
Тзблнца7. Некоторые D-аминокислоты, встречающиеся в природных аолипептидах
|
Возможно, D-аминокислоты оказались более пригодными для защитных функций организмов (именно этой цели служат и капсула бактерий, и антибиотики), в то время как L-амннокислоты нужны организму для построения белков.
Распространение отдельных аминокислот в разных белках
К настоящему време& и расшифрован аминокислотный состав многих белков микробного, растительного и животного происхождения.
Наиболее часто в белках находят аланин-, глицин, лейцин, серии. Однако каждый белок имеет свой аминокислотный состав. Например, протамины (простые белки, находящиеся в молоках рыб) содержат до 85% аргинина, но в них отсутствуют циклические, кислые-и серусодержащие аминокислоты, треонин и лиэин. Фиброин — белок натурального шелка, содержит до 50% глицина; в состав коллагена — белка сухожилий — входят редкие аминокислоты (гидроксилизин. гидроксипролин), которые отсутствуют s остальных белках.
Аминокислотный состав белков определяется не" доступностью или незаменимостью той или иной аминокислоты, а назначением белка, его фушшаей. Последовательность расположения аминокислот в белке обусловлена генетическим кодом.
3. Строение н уровни структурной организации белков
Выделяют четыре уровня структурной организации белков: первичный, вторичный, третичный и четвертичный. Каждый уровень имеет свои особенности.
Первичная структура белка
 гидроксинролина, то она имеет другой вид:
гидроксинролина, то она имеет другой вид:
|
|
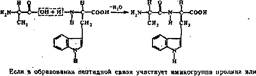
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура — простейщнй уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между («•аминогруппой одяой аминокислоты и а-карбоксильиой группой другой ами-' нокислоты:
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она- имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
1) копланарность — все атомы, входящие в пептидную группу, находятся в одной плоскости;
2) способность существовать в двух резонансных формах (кето- или енольной форме);
3) транс-положение замести гелей по отношению к С—N-связи;
4) способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
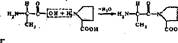
Исключение составляют пептидные группы с участием аминогруппы про- лина или гндроксипролнна. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, гак как не удерживается, как обычно, второй водородной связью.
Номенклатура пептидов и полипептидов. Название пептидов складывается из названий входящих в них аминокислот. Две аминокислоты дают дипептид, три — трипептид, четыре — тетрапептид и т. д. Каждый пептид или полнлептидная цепь любой длины имеет N-концевую аминокислоту, содержащую свободную аминогруппу, и С-концевую аминокислоту, содержащую свободную карбоксильную группу. Называя полипептиды, перечисляют последовательно все аминокислоты, начиная с N-концевой, заменяя в их названиях, кроме С-концевой, суффикс -ин на -ил (так как аминокислоты в пептидах имеют уже не карбоксильную группу, а карбонильную). Например, название изображенного на рис. 2 трипептида — лейцилфенилаланнлтреонин.
Особенности первичной структуры белка. В остове полипептидной цепи чередуются жесткие структуры
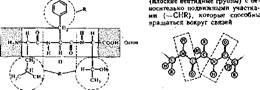
|
| Рис. 2. Схема строения трипептида |
| Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве. |
Вторичная структура белка
Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или.смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (а-слираль) и слоисто-складчатые (p-структура и кросс-0-форма).
а-Спираль. Это разновидность вторичной структуры белка, имеющая вид регулярной спирали, образующейся благодаря межлептидным водородным связям в пределах одной полипептидной цепи. Модель строения а-спирали (рис. 3), учитывающая все свойства пептидной связи, была предложена Полингом и Кори.
Основные особенности а-спирали:
|
|