
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация факторов транскрипции
|
|
| Фактор транскрипции | Характеристика |
| Суперкласс 1: факторы с основными доменами (basic domains) Класс 1.1: факторы с доменами типа " лейциновая застежка" (leucine zipper) (bZIP) | К ДНК-связывающему участку полипептидной цепи, обогащенному основными аминокислотными остатками, примыкает домен типа " лейциновая застежка", в котором каждым седьмым аминокислотным остатком является Leu. Этот домен обеспечивает димеризацию факторов, необходимую для их взаимодействия с ДНК. Все боковые остатки Leu выступают с одной стороны a-спирали и при воздействии двух полипептидных цепей переплетаются друг с другом, как в застежке-молнии, что обеспечивает специфичность димеризации. Во время взаимодействия димера с ДНК основные участки полипептидных цепей также приобретают a-спиральную конформацию. Предполагают, что два a-спиральных участка А и В, разделенные точкой перегиба, при связывании с ДНК захватывают ее наподобие ножниц. При этом ДНК контактирует с полипептидными цепями своей большой бороздкой на протяжении одного витка спирали. В классе семь семейств: 1) AP-1-подобные факторы (включает семь подсемейств: Jun, Fos, Maf, NF-E2, AP-1-подобные факторы грибов, CRE-BP/ATF и прочие факторы; всего 47 факторов); 2) CREB (CREB, ATF-1, CREM, BBF-2, dCREB2, SCO1, HAC1, Pcr1; всего 31 фактор); 3) С/EBP-подобные факторы (C/EBPa–e, CHOP-10; всего 13 факторов); 4) bZIP/PAR (DBP, VBP, Hlf, TEF; всего четыре фактора); 5) G-бокс-связывающие факторы растений (пять подсемейств: CPRF-2, EmBP-1, HBP-1a, TGA-1a, TGA-1b; всего 24 фактора); 6) только ZIP (SWI6, STE4; всего пять факторов); 7) другие факторы bZIP (Giant, OPI1). Общее число известных факторов в классе – 126. |
| Класс 1.2: факторы с доменами типа " спираль–петля–спираль" (helix–loop–helix) (bHLH) | К ДНК-связывающему участку полипептидной цепи, обогащенному основными аминокислотными остатками, примыкают две амфипатические a-спирали (см. ниже), соединенные друг с другом полипептидными петлями разной длины. Мотив " спираль–петля–спираль" (HLH) обеспечивает димеризацию факторов и их взаимодействие с ДНК, а область факторов, обогащенная основными аминокислотами, определяет специфичность ДНК-белкового взаимодействия. Во время димеризации a-спирализация полипептидных цепей факторов может значительно усиливаться, а после связывания димеров с ДНК основные домены также a-спирализуются. В димере все четыре HLH-домена, по-видимому, ориентированы параллельно друг другу. В классе девять семейств: 1) повсеместно распространенные факторы (класс А) (E2A, HEB/SCBP, Daughterless; всего девять факторов); 2) миогенные факторы транскрипции (MyoD, Myogenin, Myf-5; всего восемь факторов); 3) Achaete–Scute (Scute, Achaete, MASH-1; всего девять факторов); 4) Tal/Twist/Atonal/Hen (подсемейства: лимфоидные факторы, мезодермальные Twist-подобные факторы, HEN, Atonal, панкреатические факторы; всего 27 факторов); 5) Hairy (подсемейства: Hairy, Esp, регуляторы грибов; всего 12 факторов); 6) факторы с PAS-доменом (Ahr, Arnt; всего четыре фактора); 7) INO (INO2, INO4); 8) факторы, содержащие только HLH-домен (Emc, Id1, Olf-1; всего девять факторов); 9) другие bHLH-факторы (Deliah, Lc, CBF1). Общее число известных факторов в классе – 82. |
| Класс 1.3: факторы с двойными доменами спираль–петля–спираль/лейциновая застежка (bHLH–ZIP) | ДНК-связывающий участок обогащен остатками основных аминокислот, к которому примыкают две амфипатические a-спирали, соединенные полипептидной петлей, а также домен типа " лейциновая застежка". HLH-мотив обеспечивает димеризацию факторов, необходимую для их взаимодействия с ДНК. В димеризации также участвуют остатки Leu мотива " застежка". У факторов, связавшихся с ДНК, значительно усиливается a-спирализация полипептидных цепей. В димерах HLH-домены ориентированы параллельно друг другу. Область, обогащенная основными аминокислотами, обеспечивает специфичность взаимодействия факторов с ДНК. В классе два семейства: 1) повсеместно распространенные факторы bHLH–ZIP (подсемейства: TFE3, USF, SREBP, AP-4; всего 16 факторов); 2) факторы, контролирующие клеточный цикл (Myc, Mad/Max, E2F, DRTF; всего 26 факторов). Общее число известных факторов в классе – 42. |
| Класс 1.4: NF-1 | В классе одно семейство ядерных факторов NF-1 (22 фактора). |
| Класс 1.5: RF-X | Фактор RF-X1 идентифицирован как трансактиватор энхансера I вируса гепатита В, входит в состав семейства гомодимерных и гетеродимерных факторов транскрипции. В классе одно семейство RF-X, включающее 5 представителей: RF-X1–RF-X5 |
| Класс 1.6: bHSH | В классе одно семейство AP-2 (AP-2α, AP-2β, AP-2γ). Общее число известных факторов в классе – семь. |
| Суперкласс 2: факторы с ДНК-связывающими доменами, содержащими ион цинка в координационном центре Класс 2.1: факторы типа ядерных рецепторов, содержащие мотив " цинковые пальцы" Cys4 | Все факторы содержат домен " цинковые пальцы", характерный для ядерных рецепторов. По два таких домена различного размера, аминокислотного состава и механизма действия присутствуют в каждой молекуле рецептора. Каждый палец содержит четыре остатка Cys, координирующих ион Zn2+. Половина домена, включающая вторую пару остатков Cys, образует a-спираль. Спираль первого пальца взаимодействует с большой бороздкой ДНК. Последовательность между первыми двумя остатками Cys обеспечивает димеризацию факторов, связавшихся с ДНК. В классе два семейства: 1) рецепторы стероидных гормонов (подсемейства: рецепторы кортикоидов (GR), прогестерона (PR), андрогенов (AR), эстрогенов (ER); всего десять факторов); 2) факторы, подобные рецепторам тиреоидных гормонов (подсемейства: рецепторы ретиноевой кислоты (RAR), ретиноида X (RXR), тиреоидных гормонов (T3R), витамина D (VDR), NGFI-B, FTZ-F1, PPAR, EcR, ROR, TII/COUP, HNF-4, CFI, Knirps; всего 69 факторов). |
| Класс 2.2: факторы с разными доменами типа " цинковые пальцы" Cys4 | Каждая молекула факторов содержит по два домена типа " цинковые пальцы" GATA-типа. Каждый палец включает четыре остатка Cys, по-видимому, координирующих один ион Zn2+, однако хелатные агенты не подавляют взаимодействие факторов с ДНК. В классе три семейства: 1) GATA-факторы (подсемейства: GATA-факторы позвоночных и метаболические регуляторы грибов, всего девять факторов); 2) Trithorax (Ttx, Hrx); 3) прочие факторы (BUF2); всего 12 факторов. |
| Класс 2.3: факторы с доменами типа " цинковые пальцы" Cys2His2 | Все факторы содержат мотив " цинковые пальцы" типа TFIIIA/Krueppel, в котором каждый палец включает по два остатка Cys и His, координирующих ион Zn2+. В некоторых случаях один остаток His может быть заменен на остаток Cys. Ион Zn2+ необходим для взаимодействия факторов с ДНК. Первая половина аминокислотной последовательности пальца обычно образует два антипараллельных b-слоя, а вторая половина организована в a-спираль и частично 3–10-спираль. Гидрофобные связи между b-слоями и a-спиралями образуются при участии консервативных остатков Phe и Leu. Факторы взаимодействуют с большой бороздкой ДНК a-спиральными участками полипептидных цепей. Последовательность аминокислот, связывающая пальцы, чаще всего TGEKPI. В классе пять семейств: 1) повсеместно распространенные факторы (TFIIIA, Sp1, YY1; всего пять факторов); 2) регуляторы развития или клеточного цикла (подсемейства: Egr/Krox, Kruppel-подобные факторы, GLI-подобные факторы и прочие факторы; всего 36 факторов); 3) метаболические регуляторы грибов (CE2, CreA; всего шесть факторов); 4) большие факторы с NF-6B-подобными ДНК-связывающими свойствами (HIV-EP1, aA-CRYBP1, AGIE-BP1; всего шесть факторов); 5) регуляторы вирусов (T-Ag). Всего в классе 55 факторов. |
| Класс 2.4: факторы, содержащие кластер из шести остатков Cys, координирующих два иона Zn2+ | Все факторы содержат кластер из шести остатков Cys, координирующих два иона Zn2+. Это означает, что две из шести SH-групп координируют по два иона Zn2+ каждая. Часто встречаются у грибов. В классе одно семейство: метаболические регуляторы грибов (ARG RII, GAL4, UGA3; всего 11 факторов). |
| Класс 2.5: факторы, содержащие домены типа " цинковые пальцы" переменного состава | В классе два семейства: 1) факторы с доменами типа " цинковые пальцы" Cx7Hx8Cx4 (BAF1); 2) факторы с доменами типа " цинковые пальцы" Cx2Hx4Hx4C (Bir3). Всего в классе два фактора. |
| Суперкласс 3: факторы с доменами типа " спираль–поворот–спираль" | |
| Класс 3.1: факторы, содержащие гомеодомены | Все факторы содержат в полипептидных цепях три последовательно расположенных a-спиральных участка. Спираль 3 контактирует преимущественно с большой бороздкой ДНК, однако обнаружены контакты и с малой бороздкой. Пространственное расположение спиралей 2 и 3 напоминает таковое у регуляторов транскрипции прокариот. В классе четыре семейства: 1) факторы, содержащие только гомеодомены (подсемейства: AbdB, Antp, Cad, Cut, Dll, Ems, En, Eve, Prd, HD-ZIP, H2.0, HNF1, Lab, Msh, NK-2, Bcd, XANF, PBS, неопределенное; всего 158 факторов); 2) факторы, содержащие POU-домены (подсемейства: I, II, III, IV, V, VI, другие POU-факторы; всего 58 факторов); 3) факторы, содержащие гомеодомены с LIM-областью (подсемейства: факторы с гомеодоменами, содержащими LIM-область; (ко)факторы с гомеодоменами, содержащими только LIM-область, всего 15 факторов); 4) факторы с гомеодоменами и мотивами типа " цинковые пальцы" (представители: ATBF1, Zfh1; всего четыре фактора). Общее число известных факторов в классе – 235. |
| Класс 3.2: факторы, содержащие парный бокс | Все факторы содержат ДНК-связывающий домен длиной в ~130 аминокислотных остатков. Как правило, его N-концевая половина обогащена основными аминокислотами, а C-концевая половина сильно поляризована. Домен, по-видимому, содержит три a-спиральных участка. В классе два семейства: 1) факторы, содержащие парный бокс и гомеодомен (Prd, Pax-3; всего семь факторов); 2) факторы, содержащие только парный бокс (Pax-1, Pax-2; всего девять факторов). |
| Класс 3.3: факторы, содержащие домены типа " Fork head/winged helix" | Сгруппированы на основании гомологии с факторами транскрипции HNF-3 мышей и Fkh дрозофилы. Домен составлен из ~ 110 аминокислотных остатков, которые компактно организованы в три a-спиральных участка. Третья a-спираль контактирует с большой бороздкой ДНК. Домен образует также несколько контактов с малой бороздкой. Взаимодействие факторов с ДНК приводит к ее изгибу под углом ~13°. В классе три семейства: 1) регуляторы развития (представители: Fkh, Slp1, всего 11 факторов); 2) тканеспецифические регуляторы (представители: HNF-3, SGF-1, всего пять факторов); 3) другие регуляторы (представители: ILF, FKHR, HTLF, всего 26 факторов). |
| Класс 3.4: факторы теплового шока | Взаимодействуют с ДНК, организованной в нуклеосомы, только в присутствии основного фактора транскрипции TBP. В классе одно семейство HSF (девять факторов). |
| Класс 3.5: факторы, содержащие кластеры Trp | Полипептидные цепи факторов содержат кластеры смежных триптофановых остатков. Кластеры разделены участками цепи длиной 12–21 остаток (в семействе Myb 19–21 остаток). В классе три семейства: 1) Myb (Myb и Myb-подобные факторы соответственно 15 и пять факторов); 2) факторы Ets-типа (c-Ets-1, Erg-1; всего 36 факторов); 3) факторы, регулируемые интерфероном (IRF-1, Pip; всего семь факторов). Всего в классе 63 фактора. |
| Класс 3.6: факторы, содержащие TEA-домены | TEA-домен полипептидной цепи, содержит три α -спирали. Между спиралями 1 и 2 расположены 16–18 остатков аминокислот, а между спиралями 2 и 3 – три–восемь остатков, с неупорядоченной пространственной структурой. Установлено, что указанный домен фактора TEF-1 взаимодействует с ДНК и, по крайней мере, еще два участка полипептидной цепи создают контакты фактора с матрицей. В классе одно семейство TEA (представители: TEF-1, Sd, всего четыре фактора). |
| Суперкласс 4: факторы с доменами b-Scaffold, контактирующие с малой бороздкой ДНК Класс 4.1: факторы, содержащие RHR-домен (Rel homology region) | ДНК-связывающий домен Rel-типа содержит два субдомена, каждый из которых организован в два β -цилиндра с пятью петлями, участвующими в контактах с большой бороздкой ДНК. Наибольший вклад в специфичность взаимодействия вносит первая петля N-концевого субдомена, которая сильно консервативна. Участие полипептидных петель в контактах белок–ДНК обеспечивает факторам возможность взаимодействия с разными нуклеотидными последовательностями. Дополнительные взаимодействия осуществляются через α -спиральные участки N-концевых частей факторов, которые образуют прочные контакты с малой бороздкой ДНК. Второй C-концевой домен обеспечивает главным образом димеризацию белков. В классе 3 семейства: 1) Rel/ankyrin-факторы (NF-kB1, RelA; всего 11 факторов); 2) только ankyrin-факторы (IkBa, Bcl-3; всего 8 факторов), 3) NF-AT (6 факторов). Общее число факторов – 25. |
| Класс 4.2: p53 | ДНК-связывающий домен организован в виде β -сэндвича, который является остовом для двух больших петель и мотива типа " петля–слой–спираль". N-Концевые участки трех петель (остатки 112–124) образуют контакты с большой бороздкой ДНК в каноническом сайте связывания, тогда как C-концевая петля (остатки 236–251) связывают малую бороздку в AT-богатом центре сайта связывания. Остаток Arg-248 C-концевой части ДНК-связывающего домена, который чаще всего изменяется под действием мутаций, образует дополнительные контакты с малой бороздкой. Ион Zn2+ связывается остатками Cys-176 и His-179, находящимися в составе мотива " петля–спираль", а также остатками Cys-238 и Cys-242 (в составе С-концевой петли). В классе одно семейство p53 (p53 и p53as). |
| Класс 4.3: факторы, содержащие MADS-бокс | ДНК-сязывающие домены обеспечивают димеризацию факторов. В димере, связанном с ДНК, как это показано для фактора SRF, две амфипатические a-спирали образуют соленоид (coiled coil) и ориентированы вдоль малой бороздки ДНК. Эти спирали формируют контакты с большой и малой бороздками. В месте изгиба ДНК обернута вокруг белка. В центре изгиба малая бороздка сжата, а по бокам большие бороздки растянуты. В классе три семейства: 1) регуляторы дифференцировки (подсемейства: MEF-2A-D, факторы гомеотических генов, регуляторы дрожжей; всего 53 фактора); 2) респондеры внешних сигналов (два представителя: SRF, RLM1); 3) регуляторы метаболизма (один представитель: ARG RI). Общее число факторов – 57. |
| Класс 4.4: факторы, содержащие b-цилиндр (barrel) и a-спиральные участки | В классе одно семейство E2 (E2 и EBNA-1). |
| Класс 4.5: TATA-связывающие белки | Для полипептидов характерны консервативный С-концевой и дивергировавший N-концевой участки. Последний необходим для взаимодействия с промоторами Pol II и Pol III, содержащими TATA-бокс, но не с промоторами Pol I, в которых эта последовательность отсутствует. Может связывать ДНК в виде мономера, сгибая молекулу; входит в состав различных TAF. В классе одно семейство: TBP (с одним представителем TBP). |
| Класс 4.6: HMG-факторы | Белки этого класса обладают гомологией с хромосомными белками, принадлежащими к группе негистоновых белков с высокой электрофоретической подвижностью (HMG). Участок гомологии содержит ДНК-связывающий домен, который в одних случаях, как и у HMG1, обеспечивает белкам неспецифическое взаимодействие с ДНК, а в других (например у фактора LEF-1) – сайт-специфическое. Домен обнаруживает типичную конформацию в форме буквы L с тремя α -спиралями. Третья спираль вместе с N-концевой частью спирали 1 далеко выдвинуты и образуют длинную часть L-образного домена, а C-концевая часть спирали 1 и спираль 2 – короткую. Взаимодействие с малой бороздкой ДНК вызывает резкий (более чем на 90°) ее изгиб в сторону от белка. Общая топология комплекса напоминает таковую комплекса TBP–TATA-бокс. В классе шесть семейств: 1) SOX (SRY, Sox; всего 15 факторов); 2) TCF-1 (всего 12 факторов); 3) HMG2-подобные факторы (SSRP1, Ixr1; всего четыре фактора); 4) UBF (три фактора); 5) MATA (один фактор: mat-Mc); 6) прочие факторы, содержащие HMG-бокс (всего три фактора). Общее число факторов – 38. |
| Класс 4.7: гетеромерные CCAAT-факторы | Включает одно семейство: гетеромерные CCAAT-факторы (CP1A/HAP3, CBF-C/HAP-4). Общее число факторов – шесть. |
| Класс 4.8: Grainyhead | Включает одно семейство Grainyhead. Всего в классе три фактора: CP2, LBP-1a и Grainyhead |
| Класс 4.9: факторы с доменом холодового шока | Обладают протамино-подобным доменом: последовательностью аминокислот с большим суммарным положительным зарядом, содержащей неупорядоченные остатки Pro. Включает одно семейство csd с семью факторами (DbpA–B, FRG, YВ1–3 и др.). |
| Класс 4.10: Runt | Белки этого класса обладают гомологией с характерным участком полипептидной цепи белка Runt дрозофилы. Домен Runt является частью ДНК-связывающего домена этих факторов. Он сформирован в основном β -слоями, которые не содержат α -спиральных участков, и напоминает домен типа пальмовой ветви, обнаруженный у ДНК-полимеразы β крыс. В классе одно семейство: Runt. (PEBP2a, Runt; всего 15 факторов). |
| Суперкласс 0: прочие факторы транскрипции | |
| Класс 0.1: медь-связывающие белки | Медь-зависимый активатор гена металлотионеина (CUP1) у дрожжей. Не содержит доменов типа " цинковые пальцы". В классе одно семейство: регуляторы грибов (всего два фактора: ACE1/CUP2 и AMT1). |
| Класс 0.2: HMGI(Y) | Вспомогательные факторы для других факторов транскрипции, таких как NF-kB или ATF-2. Облегчают их включение в транскрипционный комплекс. В классе одно семейство: HMGI (Y), включающее четыре фактора. |
| Класс 0.3: STAT | Содержат домен, подобный лейциновой застежке, а также ДНК-связывающий домен, определяющий специфичность взаимодействия факторов с ДНК. Содержат домены SH2 и SH3, первый из которых необходим для гомо- и гетеродимеризации факторов, фосфорилированных по остатку Tyr. Опосредуют перенос сигналов фосфорилирования к генам, индуцируемым интерфероном. В классе одно семейство: STAT, включающее восемь факторов. |
| Класс 0.4: факторы, содержащие домен Pocket | В классе два семейства: 1) Rb (Rb – продукт антионкогена ретинобластомы и p107); 2) CBP (один представитель). |
| Класс 0.5: E1A-подобные факторы | В классе одно семейство: E1A (два представителя). |
| Класс 0.6: AP2/EREBP-подобные факторы | В классе три семейства: AP2 (четыре фактора); EREBP (ABI4, EBP, ERF1, TINI, всего 14 представителей); AP2/B3 (RAV1 и RAV2). |
Ниже будут подробнее рассмотрены особенности структуры некоторых наиболее часто встречающихся структурно-функциональных доменов факторов транскрипции и механизмы их регуляторного действия на транскрипцию генов.
Факторы транскрипции в роли позитивных регуляторов (активаторов) синтеза РНК. Изучение механизмов функционирования белковых факторов транскрипции – задача непростая. Прежде всего, это связано с их малой концентрацией в клетках и большими сложностями получения факторов в очищенном состоянии для дальнейших биохимических исследований. Развитие генно-инженерных методов позволило получать факторы транскрипции в неограниченных количествах, что не замедлило принести плоды в виде новой информации (подробнее о методах клонирования генов см. в главе 7).
Для того чтобы фактор транскрипции оказал специфическое действие на синтез РНК определенным геном, он, прежде всего, должен распознать этот ген и связаться с определенной последовательностью ДНК. Затем фактор транскрипции должен взаимодействовать с другими факторами или непосредственно с самой РНК-полимеразой для стимуляции или подавления транскрипции на этом гене. Кроме того, необходимость включения и выключения транскрипции в строго определенных месте и времени (тканеспецифический характер экспрессии генов на разных стадиях онтогенеза организма) предполагает наличие механизмов контроля биосинтеза или активации самих факторов транскрипции для упорядочивания их функционирования. Ниже будут рассмотрены механизмы, обеспечивающие эти три этапа функционирования факторов транскрипции – связывание с ДНК, влияние на процесс транскрипции и регуляция их собственной активности.
Механизмы взаимодействия факторов транскрипции с ДНК. Клонирование генов факторов транскрипции (и их фрагментов), а также выделение соответствующих рекомбинантных белков позволили идентифицировать участки их полипептидных цепей, обеспечивающие специфическое взаимодействие факторов с ДНК. Очищенные фрагменты белков были исследованы на способность взаимодействовать с определенными последовательностями ДНК. Это позволило обнаружить несколько структурных элементов (доменов) полипептидных цепей, общих для факторов транскрипции разных типов, которые легли в основу их современной классификации.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение

Рис. I.24. Особенности структуры полипептидных доменов типа " цинковые пальцы" и их взаимодействие с ДНК
а – схема строения домена, содержащего Zn-связывающие остатки Cys (C) и Hys (H); б – предполагаемый механизм взаимодействия доменов типа " цинковые пальцы", изображенных в виде цилиндров, с ДНК. Стрелки указывают полярность цепей ДНК 5’®3’; в – схема строения доменов типа " цинковые пальцы", содержащих только Zn-связывающие остатки Cys. Квадратными скобками отмечены участки полипептидных цепей, участвующие в распознавании палиндромных последовательностей ДНК (А и Б)
Домены типа " цинковые пальцы". Одним из первых факторов транскрипции, полученных в виде очищенного рекомбинантного белка, был фактор TFIIIA, который играет ключевую роль в транскрипции генов 5S рРНК РНК-полимеразой III. ДНК-связывающий участок полипептидной цепи этого фактора содержит девять 30-звенных повторов: Tyr/Phe-Xaa-Cys-Xaa-Cys-Xaa2, 4-Cys-Xaa3-Phe-Xaa5-Leu-Xaa2-His-Xaa3, 4-His-Xaa5, где Xaa – остаток любой аминокислоты. Таким образом, каждый из повторов содержит две строго консервативные пары остатков Cys и His, которые взаимодействуют с одним ионом цинка. Это приводит к образованию в свернутой полипептидной цепи пространственной структуры, сформированной консервативными остатками Phe, Leu и несколькими остатками основных аминокислот. Структура выступает над поверхностью белковой глобулы в виде " пальца" (рис. I.24, а). Вершины пальцев непосредственно контактируют с большой бороздкой ДНК, причем соседние пальцеобразные структуры связываются противоположными сторонами спирали ДНК (см. рис. I.24, б).
Домены типа " цинковые пальцы" обнаружены у многих факторов транскрипции, обеспечивающих функционирование РНК-полимеразы II, в том числе у фактора Sp1, Kruppel-белка Drosophila, белков ADRI и GAL4 дрожжей и белка аденовируса E1A. Интересно, что точковая мутация в гене Kruppel-белка, приводящая к замене лишь одного из остатков Cys на Ser, что, в свою очередь, предотвращает связывание иона Zn2+, фенотипически проявляется как делеция целого гена этого фактора. На данном основании был сделан вывод о том, что способность связывать ионы Zn2+ является критической для проявления ДНК-связывающей активности факторов такого типа.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Аналогичные домены обнаружены в полипептидных цепях семейства рецепторов тиреоидных или стероидных гормонов, которые в комплексе с гормонами после переноса в ядра специфически взаимодействуют с определенными последовательностями ДНК, изменяя уровни транскрипции соответствующих генов-мишеней. Однако в этом случае ДНК-связывающие участки состоят из двух пальцев, каждый из которых содержит четыре остатка Cys, взаимодействующие с ионом Zn2+, вместо двух Cys и двух His (см. рис. I.24, в); у них также отсутствуют консервативные остатки Phe и Leu. Кроме того, элемент из двух цинковых пальцев встречается в полипептидных цепях таких рецепторов только один раз, тогда как в генах, кодирующих цинковые пальцы с Cys–His, подобный элемент может повторяться от 2 до 37 раз.
Исследование мест связывания различных рецепторов стероидных гормонов с ДНК показало, что они взаимодействуют с гомологичными, но не идентичными регуляторными последовательностями нуклеотидов (подчеркнуты):
| Глюкокортикоиды/прогестерон | GGTACA NNN TGTTCT |
| Эстрогены | AGGTCA NNN TGACCT |
| Тиреоидные гормоны/ретиноевая кислота | TCAGGTCA --- TGACCTGA, |
где N – любые нуклеотиды, --- – отсутствие нуклеотидов.
Методами направленного мутагенеза установлено, что специфичность взаимодействия этих рецепторов со своими последовательностями определяется небольшим числом аминокислотных остатков. Так, замена всего лишь двух аминокислотных остатков в N-концевой части цинкового пальца рецептора глюкокортикоидов на аминокислотные остатки, обнаруживаемые в том же самом участке рецептора эстрогенов, приводит к тому, что мутантный рецептор начинает взаимодействовать с регуляторными последовательностями, узнаваемыми рецепторами эстрогенов, и активировать гены, контролируемые этими последовательностями. Аналогичные замены пяти аминокислотных остатков во втором пальце рецептора эстрогенов также приводят к изменению его специфичности: он приобретает способность взаимодействовать с регуляторной последовательностью тиреоидных гормонов. Как уже упоминалось выше, оба рецептора узнают одни и те же последовательности нуклеотидов, различающиеся лишь расстояниями между ними. При этом первый цинковый палец играет ключевую роль в узнавании последовательности как таковой, а второй определяет оптимальное для взаимодействия расстояние между двумя половинками этой последовательности.
Факторы транскрипции, содержащие мотив " спираль–поворот–спираль".Другой тип пептидных доменов, специфически распознающих регуляторные последовательности на ДНК, характерен для белковых продуктов гомеотических (гомеозисных) генов, впервые обнаруженных у дрозофилы. Гомеотические гены позвоночных и растений играют ключевую роль в их морфогенезе. Полипептидные цепи белков, кодируемых этими генами, содержат высококонсервативную последовательность длиной в 60 аминокислотных остатков, называемую гомеобоксом, или гомеодоменом, которая определяет специфичность взаимодействия белков с регуляторными последовательностями ДНК. Анализ третичной структуры гомеодоменов показал, что они образуют структуру типа " спираль–поворот–спираль" (helix–turn–helix), в которой за a-спиральным участком следует b-структура с последующим еще одним a-спиральным участком (рис. I.25, а). Наличие этой пространственной структуры, существование которой было впервые предсказано на основании гомологии с соответствующими аминокислотными последовательностями бактериальных белков-репрессоров, в настоящее время строго доказано методами ЯМР-спектроскопии, в частности для гомеодомена продукта гена Antennapedia дрозофилы.

Рис. I.25. Структуры полипептидных доменов типа " спираль–поворот–спираль" (а) и " лейциновая застежка" (б)
L – остатки Leu
Для бактериальных белков-репрессоров было показано, что при образовании специфических комплексов с ДНК первый a-спиральный участок расположен перпендикулярно большой бороздке ДНК, тогда как второй частично находится в ней и обеспечивает специфические контакты репрессора с операторным участком ДНК. Ключевая роль второго a-спирального участка гомеодомена при изучении специфичности взаимодействия этих белков с ДНК была определена с помощью мутаций. Так, замена только одного остатка Ser в положении 9 a-спирали белка Prd на Gln, присутствующий в гомеозисном белке Ftz, приводит к связыванию белка Prd с Ftz-сайтами на ДНК.
Позднее была обнаружена большая группа регуляторных белков, в которых гомеобоксы формируют лишь одну часть более протяженного консервативного домена, названного POU-доменом. Эти белки, к которым относятся, в частности, октамерсвязывающие белки (octamer binding proteins) Oct-1 и Oct-2, белок гипофиза Pit-1 и продукт гена unc-86 нематод, используют POU-домены для специфического взаимодействия с ДНК. Относительный вклад аминокислотной последовательности гомеобокса и негомебоксной POU-последовательности в специфичность связывания белок-ДНК не одинаков для разных белков. Так, в белке Pit-1 специфичность в основном достигается за счет гомеодомена, тогда как в белке Oct-1 основную роль играет другая последовательность POU-домена.
ДНК-связывающий домен типа " лейциновая застежка". Сравнение аминокислотных последовательностей ряда других факторов транскрипции: фактора транскрипции печени C/EBP, дрожжевого фактора GCN4, а также белков-продуктов протоонкогенов Myc, Fos и Jun (протоонкогены – это гены, мутации в которых могут приводить к злокачественному перерождению клеток), позволило выявить еще одну консервативную аминокислотную последовательность, образующую пространственную структуру, названную " лейциновой застежкой" (leucine zipper). В этой структуре остатки Leu, находящиеся в составе a-спирального участка полипептидных цепей факторов, расположены через каждые шесть аминокислотных остатков на равном расстоянии друг от друга и оказываются на одной стороне a-спирали через каждые два витка (см. рис. I.25, б). Такие домены сами по себе не связываются с ДНК, однако обеспечивают димеризацию содержащих их факторов путем взаимопроникновения лейциновых a-спиралей двух молекул факторов. В результате в димере появляются две правильно расположенные друг относительно друга полипептидные цепи, составленные преимущественно из основных аминокислотных остатков, которые и образуют ДНК-связывающий центр фактора транскрипции.
Димеры белков Fos и Jun связываются с Ap-1-последовательностями ДНК, что сопровождается активацией соответствующих генов в ответ на воздействие форболовыми эфирами. Однако если белок Jun связывается с Ap-1-последовательностями нуклеотидов в виде гомодимера (белкового комплекса, состоящего из двух идентичных полипептидных цепей), то белок Fos специфически взаимодействует с ДНК только после образования комплекса (гетеродимера) с белком Jun. Эти свойства двух белков являются следствием различий в структуре их лейциновых доменов, которые не позволяют образовываться гомодимеру из полипептидных цепей Fos. Искусственная замена лейцинового домена Fos на соответствующий домен белка Jun обеспечивает условия для получения гомодимера из таких химерных полипептидных цепей. Необходимость образования димера этих двух регуляторных белков перед взаимодействием с ДНК создает дополнительную возможность воздействия на экспрессию соответствующих генов путем контроля над формированием самого белкового комплекса фактора транскрипции.
Основной ДНК-связывающий домен, впервые обнаруженный у белков, содержащих " лейциновую застежку", позднее был найден и у ряда других белков, регулирующих транскрипцию, в частности у двух белков E12 и E47, которые взаимодействуют с энхансерами иммуноглобулиновых генов, у регуляторного белка мышц MyoD1 и у некоторых белков дрозофилы. Однако в этих случаях основной домен расположен по соседству с участком полипептидной цепи, образующим домен типа " спираль–поворот–спираль", в котором две амфипатические спирали (содержащие все заряженные аминокислотные остатки на одной стороне спирали) разделены неспирализованной петлей. Предполагают, что такой домен играет ту же роль в димеризации полипептидных цепей и формировании ДНК-связывающего центра, что и описанные выше регуляторные полипептиды, содержащие лейциновые домены.
Следует еще раз подчеркнуть, что структуры типа " лейциновая застежка" и " спираль–поворот–спираль" необходимы для димеризации полипептидных цепей транскрипционных факторов, принадлежащих к данной группе, что сопровождается формированием основного ДНК-связывающего участка регуляторных белков. Белок протоонкогена myc содержит как лейциновый домен, так и домен типа " спираль–поворот–спираль" по соседству с основным ДНК-связывающим доменом. В соответствии с этим все данное семейство регуляторных белков можно разделить на подсемейства, в которых полипептидные цепи факторов транскрипции содержат порознь или одновременно домены типа " лейциновая застежка" или " спираль–поворот–спираль".
Таковы особенности структуры некоторых наиболее хорошо изученных доменов факторов транскрипции, обеспечивающих специфичность взаимодействия последних с регуляторными последовательностями ДНК, что необходимо для их регуляторного воздействия на транскрипцию соответствующих генов. Количество известных доменов у факторов транскрипции быстро возрастает с развитием исследований в этой области. Так, новые ДНК-связывающие участки полипептидных цепей недавно обнаружены у фактора транскрипции AP2, факторов, обеспечивающих регуляторное действие сыворотки, белков CTF/NTF, взаимодействующих с CAAT-боксом, факторов транскрипции дрожжей HAP-2 и HAP-3. В белках существует несколько структур, обеспечивающих специфическое распознавание определенных последовательностей ДНК, что позволяет осуществлять передачу регуляторных сигналов к определенным генам-мишеням и служит основой для обеспечения их дифференциальной экспрессии на уровне транскрипции. Данные о некоторых наиболее важных с функциональной точки зрения доменах факторов транскрипции суммированы в табл. I.14.
Несмотря на то что специфическое связывание с ДНК является обязательным этапом для регуляторного воздействия белковых факторов на транскрипцию, реализация активности факторов часто требует их специфического взаимодействия с другими регуляторными белками, а также с самой РНК-полимеразой II. Большинство таких воздействий приводит к активации транскрипции. Однако результатом некоторых из них может быть и репрессия синтеза мРНК. Ниже будут рассмотрены условия, необходимые для осуществления позитивного действия факторов транскрипции.
Для идентификации участков полипептидных цепей факторов транскрипции, непосредственно участвующих в активации синтеза РНК, чаще всего конструируют химерные рекомбинантные белки (некоторые из них кратко описаны выше), объединяющие в одной цепи ДНК-связывающий домен и участки полипептидных цепей других факторов, и изучают влияние таких гибридных факторов на транскрипцию in vitro. В ходе исследований, основанных на подобных подходах, были идентифицированы функциональные домены факторов транскрипции, в том числе домены, участвующие в активации транскрипции, которые, как правило, отличаются от ДНК-связывающих участков их полипептидных цепей. Доменную структуру факторов транскрипции можно проиллюстрировать на примере семейства рецепторов стероидных/тиреоидных гормонов (рис. I.26). В полипептидной цепи таких факторов четко видны три функциональных модуля: ДНК-
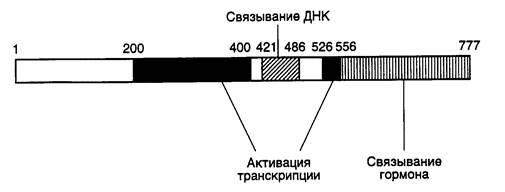
Рис. I.26. Доменная структура полипептидной цепи рецептора глюкокортикоидов
Цифрами указаны номера аминокислотных остатков на границах функциональных доменов, участвующих в активации транскрипции, связывании ДНК и гормона
Таблица I.14
|
|
