
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Практическая часть. а) Название эксперимента.
|
|
Опыт 1.
а) Название эксперимента.
Взаимодействие алюминия о щелочами.
б) Ход эксперимента.
Поместим в пробирку алюминий (стержень) Al и добавим 6 – 7 капель бесцветного раствора гидроксида натрия NaOH.
в) Наблюдения.
Сначала раствор становится розовым, бурно выделяется газ, затем раствор становится бесцветным.
г) Уравнения реакции.
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] + 3H2↑
Al0 - 3ē = Al+3 2 восстановитель реакция окисления
Н2+2 + 2ē = Н20 3 окислитель реакция восстановления
 |  |  | |||||||
 |  | ||||||||
д) Иллюстрационный материал.
 |  | ||
е) Вывод.
При реагировании алюминия Al с щелочами реакция протекает очень бурно с выделением огромного количества водорода H2. Алюминий Al проявляет кислотные свойства.
Опыт 2.
а) Название эксперимента.
Взаимодействие алюминия с солями меди (II).
б) Ход эксперимента.
Поместим в три пробирки алюминий Al. В первую добавим 6 – 7 капель голубого раствора хлорида меди CuCl2, во вторую – 6 – 7 капель голубого раствора сульфата меди CuSO4, в третью – 6 – 7 капель голубого раствора нитрата меди Cu(NO3)2.
в) Наблюдения.
В пробирке с хлоридом меди CuCl2 и сульфатом меди реакция идет очень интенсивно, выделяется газ, образуется медная пленка. В последней нет никаких изменений.
г) Уравнения реакции.
2Al + 3CuCl2 = 2AlCl3 + 3Cu
Al0 - 3ē = Al+3 2 восстановитель
Cu+2 + 2ē = Cu0 3 окислитель
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
2Al0 - 6ē = Al2+3 1 восстановитель
Cu+2 + 2ē = Cu0 3 окислитель
2Al + 3Cu(NO3)2 = реакция не идет
д) Иллюстрационный материал.
 | 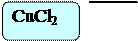 |  | |||||
 | |||||||
 | 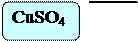 |  | |||||
 | |||||||
 | 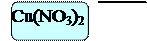 | ||||
 | |||||
е) Вывод.
Алюминий восстанавливает медь из растворов солей – хлоридов и сульфатов.
Опыт 3. Часть первая.
а) Название эксперимента.
Получение гидроксида алюминия и изучение его свойств.
б) Ход эксперимента.
В две ячейки капельного планшета поместим по капле бесцветного раствора хлорида алюминия (III) AlCl3. К каждой капле добавим по 1 капле бесцветного раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает гелеобразный белый осадок.
г) Уравнения реакции.
AlCl3 + 3NaOH = Al(OH)3 ↓ + 3NaCl
 |  |  | |||||
 | |||||||
д) Иллюстрационный материал.
 |  |  | |||
е) Вывод.
При взаимодействии солей алюминия (III) с щелочами получается гидроксид алюминия (III) Al(OH)3.
ж) Ход эксперимента.
После этого к одной капле добавим 2 капли раствора соляной кислоты HCl, а ко второй еще 2 капли раствора гидроксида натрия NaOH.
з) Наблюдения.
В обеих ячейках осадок Al(OH)3 растворяется.
и) Уравнения реакции.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4] → NaAlO2 + 2H2O
 |  |  | |||||
 | |||||||
к) Иллюстрационный материал.
 |
 |  |  | |||
 |  | 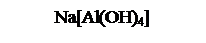 | |||||
 | |||||||
л) Вывод.
Так как гидроксид алюминия (III) Al(OH)3 растворяется и в кислоте HCl и в щелочи NaOH, то он является амфотерным.
Опыт 3. Часть 2.
м) Ход эксперимента.
К полученному раствору алюмината натрия NaAlO2 добавим несколько кристалликов хлорида аммония NH4Cl.
н) Наблюдения.
Выпадает мутный осадок.
о) Уравнения реакции.
4Na[Al(OH)4] + 4NH4Cl + H2O ↔ 2Al2O3 + 4NH4OH + 4NaCl
 | 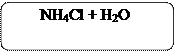 |  | |||||||
 |  | ||||||||
п) Иллюстрационный материал.
 |  |
р) Вывод.
При взаимодействии алюмината натрия NaAlO2 и хлорида аммония NH4Cl происходит совместный гидролиз этих солей.
Опыт 4.
а) Название эксперимента.
Гидролиз соли алюминия.
б) Ход эксперимента.
В ячейку капельного планшета поместим 1 каплю раствора нейтрального лакмуса, добавим к ней несколько кристалликов сульфата алюминия Al2(SO4)3.
в) Наблюдения.
Цвет раствора меняется с фиолетового на розовый.
г) Уравнения реакции.
Al2(SO4)3 + H2O = [Al(OH)2]SO4 + H2SO4
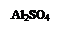 |  |  | |||||
 | |||||||
д) Иллюстрационный материал.
 |
е) Вывод.
Гидролиз соли алюминия идет по катиону, по первой ступени. Реакция среды кислая.
Опыт 5.
а) Название эксперимента.
Влияние карбоната натрия на гидролиз соли алюминия.
б) Ход эксперимента.
В ячейку капельного планшета внесем 1 каплю хлорида алюминия AlCl3 и добавим 2 капле карбоната натрия Na2CO3.
в) Наблюдения.
Выпадает гелеобразный белый осадок.
г) Уравнения реакции.
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 6NaCl
 | 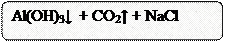 | ||||||||
 |  |  | |||||||
д) Иллюстрационный материал.
 | |||||
 |  | ||||
е) Вывод.
Карбонат натрия Na2CO3 усиливает гидролиз солей алюминия. Реакция среды щелочная.
Опыт 6.
а) Название эксперимента.
Получение гидроксида олова (II) и изучение его свойств.
б) Ход эксперимента.
В две ячейки капельного планшета поместим по капле хлорида олова (II) SnCl2. К каждой капле добавим по 1 капле раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает белый осадок.
г) Уравнения реакции.
SnCl2 + 2NaOH = Sn(OH)2 ↓ + 2NaCl
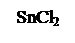 |  |  | |||||
 | |||||||
д) Иллюстрационный материал.
 |  |  | |||
е) Вывод.
При взаимодействии солей олова (II) с щелочами получается гидроксид олова (II) Sn(OH)2.
ж) Ход эксперимента.
После этого к одной капле добавим 2 капли раствора соляной кислоты HCl, а ко второй еще 2 капли раствора гидроксида натрия NaOH.
з) Наблюдения.
В обеих ячейках осадок растворяется.
и) Уравнения реакции.
Sn(OH)2 + 2HCl = SnCl2 + 2H2O
Sn(OH)2 + NaOH = Na2[Sn(OH)4
 |  |  | |||||
 | |||||||
к) Иллюстрационный материал.
 |  |
 |  |  | |||||||
 |  | ||||||||
л) Вывод.
Так как гидроксид олова (II) Sn(OH)2 растворяется и в кислоте HCl и в щелочи NaOH, то он является амфотерным.
Опыт 7.
а) Название эксперимента.
Восстановительные свойства олова (II).
б) Ход эксперимента.
В 2 ячейки капельного планшета поместим по 1 капле раствора хлорида олова (II) SnCl2. К обеим добавим по капле соляной кислоты HCl. Затем, к первой капле добавим 2 капле перманганата калия KMnO4, ко второй добавим 2 капли раствора дихромата калия K2Cr2O7.
в) Наблюдения.
Цвет раствора в ячейке с перманганатом калия меняется с фиолетового на бесцветный, а в ячейке с дихроматом меняется с оранжевого на желто - синий.
г) Уравнения реакции.
5SnCl2 + 16HCl + 2KMnO4 = 5SnCl4 + 2MnCl2 + 8H2O + 2KCl
Sn+2 - 2ē = Sn+4 5 восстановитель
Mn+7 + 5ē = Mn+2 2 окислитель
3SnCl2 + 28HCl + 2K2Cr2O7 = 2CrCl3 + 3SnCl4 + 4KCl + 14H2O
Sn+2 - 2ē = Sn+4 3 восстановитель
Cr+6 + 3ē = Cr+3 2 окислитель
 |  | ||||
 | |||||
д) Иллюстрационный материал.
 |  |  | |||||
 | |||||||
 | |||
 | |||
е) Вывод.
Олово (II) является активным восстановителем.
Опыт 8.
а) Название эксперимента.
Получение гидроксида свинца (II) и изучение его свойств.
б) Ход эксперимента.
В две ячейки капельного планшета поместим по капле ацетата свинца (II) Pb(CH3COO)2. К каждой капле добавим по 1 капле раствора гидроксида натрия NaOH.
в) Наблюдения.
Выпадает белый осадок.
г) Уравнения реакции.
Pb(CH3COO)2 + 2NaOH = Pb(OH)2 ↓ + 2NaCH3COO
 |
д) Иллюстрационный материал.
 |  | ||||||||
 |  |  | |||||||
е) Вывод.
При взаимодействии ацетата свинца (II) Pb(CH3COO)2 с щелочами получается гидроксид свинца (II) Pb(OH)2.
ж) Ход эксперимента.
После этого к одной капле добавим 2 капли раствора уксусной кислоты CH3COOH, а ко второй еще 3 капли раствора гидроксида натрия NaOH.
з) Наблюдения.
В обеих ячейках осадок растворяется.
и) Уравнения реакции.
Pb(OH)2 + 2CH3COOH = Pb(CH3COO)2 + 2H2O
Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
 |  | 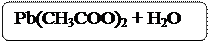 | |||||
 | |||||||
к) Иллюстрационный материал.
 | |||||
 |  | ||||
 |  | ||||||||
 |  |  | |||||||
л) Вывод.
Так как гидроксид свинца (II) Pb(OH)2 растворяется и в кислоте CH3COOH и в щелочи NaOH, то он является амфотерным.
Опыт 9.
а) Название эксперимента.
Характерная реакция на ион свинца (II).
б) Ход эксперимента.
В ячейку капельного планшета внесем 1 каплю раствора уксуснокислого Pb(CH3COO)2 свинца и добавим 1 каплю раствора йодистого калия KJ.
в) Наблюдения.
Выпадает ярко желтый осадок.
г) Уравнения реакции.
Pb(CH3COO)2 + KJ = PbJ2↓ + 2KCH3COO
д) Иллюстрационный материал.
 |  |  | |||||||
 |  | ||||||||
 |
е) Вывод.
Для того, чтобы обнаружить ион свинца Pb+2 надо провести реакцию с йодидом калия KJ. На ион свинца будет указывать ярко желтое окрашивание раствора.
Контрольные вопросы.
1. Какие вам известны комплексные соединения бора и алюминия? Какие координационные числа характерны для бора и алюминия?
Комплексные соединения:
- для бора
[B(OH)4]Cl, [BF3H]OH, [BF4]Cl
- для алюминия
Na[Al(OH)4], [Al(OH)6]Cl.
Координационные числа:
- для алюминия
4 и 6
- для бора
3 и 4
2. В растворе находятся ионы Pb2+ и Sn2+. Как их можно разделить?
Нужно провести качественную реакцию на ион свинца. Для этого нужно добавить в раствор йодид калия. При реакции со винцом выпадет ярко желтый осадок PbJ2.
3. Приведите примеры комплексных соединений олова и свинца. Какие координационные числа для них характерны?
Комплексные соединения:
- для олова
Na2[Sn(OH)6], Na2Sn(OH)4
- для свинца
Na2[Pb(OH)4]
Координационные числа:
- для свинца
- для олова
4 и 6
|
|