
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Критерий самопроизвольности процессов в изолированных системах
|
|
Основными положениями I закона термодинамики являются утверждения:
- о постоянстве количества внутренней энергии в изолированной системе;
- об эквивалентности различных форм энергии;
- о соотношении, связывающее изменение внутренней энергии системы с коли-чеством поступившей теплоты и произведенной работы.
I закон термодинамики дает представления о превращениях тепла в ходе хими-ческой реакции, но не затрагивает вопросов о характере, возможности и направле-нии процессов, при которых наблюдается превращение энергии. В природе многие естественные процессы протекают самопроизвольно в одном направлении, т.е. системы стремятся к равновесию. Известны процессы, протекающие без измене-ния энтальпии (DH = 0) или даже эндотермические (DН > 0) реакции. Исследова-ния таких процессов привело к открытию второго закона термодинамики.
Имеются несколько формулировок этого закона:
- переход теплоты от холодного тела к более теплому не может происходить без компенсации, т.е. совершения работы;
- невозможен самопроизвольный переход теплоты от холодного тела к горячему;
- любая форма энергии может полностью преобразоваться в теплоту, но теплота преобразоваться в иные формы энергии лишь частично;
- невозможно построить машину (вечный двигатель второго рода), все действия которой сводилось бы к производству работы и соответствующему охлаждению теплового источника;
- самопроизвольно протекают те процессы, в ходе которых энергия Гиббса (DG = DH – TDS) уменьшается, т.е. когда DG < 0.
Для объяснения самопроизвольного протекания процессов, идущих без изменения энтальпии и эндотермических процессов, вводится понятие энтропия S
(Дж/град . моль). Она показывает изменение рассеивания энергии при переходе системы из одного состояния в другое. Энтропия является мерой беспорядка или неупорядоченности в системе, т.е. мерой её приближения к равновесию. II закон термодинамики утверждает, что самопроизвольно протекающие процессы в изолированных системах сопровождаются увеличением суммарной энтропии системы и её окружения.
В соответствии со II законом термодинамики можно отметить:
- в изолированной системе (Q = 0, DG = -DST) необратимый процесс может проте-кать только за счёт возрастания энтропии, т.е. при DS > 0;
- в изолированной системе обратимый процесс может протекать только тогда, когда энтропия постоянна, т.е. DS = 0.
- в открытых системах энтропия может и возрастать и уменьшаться.
Изменение энтропии пропорционально количеству теплоты, которое поглощает или выделяет система и обратно пропорционально температуре, при которой идёт процесс: 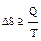 .
.
В случае необратимого процесса: 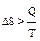 . При обратимых процессах:
. При обратимых процессах: 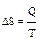 .
.
В общем виде второй закон термодинамики для изолированных систем математи-чески выражается в виде: 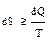 .
.
Отношение 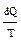 называют элементарной приведенной теплотой процесса. Таким образом, изменение энтропии системы равно приведенной теплоте, сообщенной обратимым процессом, но она больше приведенной теплоты, сообщенной необратимым процессом.
называют элементарной приведенной теплотой процесса. Таким образом, изменение энтропии системы равно приведенной теплоте, сообщенной обратимым процессом, но она больше приведенной теплоты, сообщенной необратимым процессом.
|
|