
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Тканинне дихання.
|
|
Існує уявлення про систему зовнішнього дихання.



|
До виконавчих органів належать органи 1-5. За рахунок зміни кількості м’язів, що забезпечують вдих та видих, сили їх скорочення і розслаблення змінюється глибина і частота дихання – зміна вентиляції легень – забезпечення сталого складу альвеолярного повітря. Цей результат дуже важливий, оскільки у здорової людини при проходженні крові через капіляри легень відбувається практично повне вирівнювання складу газів у альвеолах та крові. Тому постійність газового складу альвеолярного повітря є умовою сталості газового складу артеріальної крові – газовий гомеостаз.
Зовнішнє дихання здійснюється завдяки ритмічному чергуванню вдиху і видоху. Біомеханіка спокійного дихання:
1. Спокійний вдих – активний акт, тобто пов’язаний зі скороченням м’язів спокійного вдиху (зовнішні міжреберні та діафрагма).
Скорочення зовнішніх міжреберних м’язів супроводжується підняттям ребер – збільшення розмірів грудної клітки в передньо-задньому та боковому напрямках. Нижні ребра підтягуються до верхніх завдяки характерному ходу волокон – сила, що діє на обидва ребра однакова, але момент сили, що діє на нижнє ребро, більший.
Скорочення діафрагми супроводжується її сплощенням – органи черевної порожнини зміщуються донизу, а грудна клітка збільшує свій розмір у верхньо-нижньому напрямку. Роль діафрагми у здійсненні спокійного дихання більша, ніж у міжреберних м’язів – вона зміщується вниз лише на 1 см, але забезпечує 2/3 ємності спокійного вдиху. При форсованому дихані вона може зміщуватися вниз на 10 см. У більшості людей в спокої переважає діафрагмальне дихання як більш ефективне. Проте за деяких станів (вагітність, метеоризм) діафрагмальне дихання утруднене і тоді переважає реберне дихання.
Збільшення ємкості грудної клітки за рахунок скорочення м’язів вдиху супроводжується зниженням внутрішньоплеврального тиску (від -5 мм водн.ст до -7...-8 мм водн.ст). Тобто внутрішньопелвральний тиск від’ємний вже у стані видиху (нижче атмосферного), а при вдосі стає ще більш негативним. Це призводить до збільшення транспульмонального тиску (різниця тисків у альвеолах та плевральній порожнині) і легені розширюються. При цьому тиск в альвеолах стає на 2-3 мм водн. ст. нижче атмосферного і повітря за градієнтом тиску надходить в альвеоли – здійснюється вдих.
Тобто, послідовність дій при вдосі така: скорочення дихальних м’язів Ù збільшення розмірів грудної клітки Ù падіння тиску в плевральній порожнині (підвищення ступеня негативного тиску) Ù підвищення транспульмонального тиску Ù розширення легень Ù зниження тиску в альвеолах Ù рух атмосферного повітря в альвеоли за градієнтом тиску Ù вдих.
2. Біомеханіка спокійного видиху принципово відрізняється від біомеханіки спокійного вдоху тим, що видих проходить пасивно. Послідовність дій при видосі така: розслаблення м’язів вдоху Ù опускання ребер (під дією сили тяжіння, сил еластичної деформації хрящів, зв’язок, підняття діафрагми) внаслідок різниці тиску в черевній та грудній порожнині Ù зменшення об’єму грудної клітки Ù підвищення тиску в плевральній порожнині (зменшення ступеня негативності цього тиску, але він все ще залишається негативним – близько -5 см водн. ст.) Ù зменшення транспульмонального тиску Ù зменшення об’єму легень Ù підвищення тиску в альвеолах до +2 см. водн. ст.) Ù рух повітря із альвеол в атмосферу Ù видих.
Звертає на себе увагу той факт, що тиск в плевральній порожнині при спокійному диханні залишається негативним навіть при видосі. Причиною наявності негативного внутрішньоплеврального тиску є еластична тяга легень – сила, яка примушує легені спадатись (зменшуватись в об’ємі). Ця сила зумовлює зменшення об’єму легень, а тиск в плевральній порожнині за рахунок цього стає негативним.
2. Еластична тяга легень, негативний внутрішньоплевраль-ний тиск.
Еластична тяга легень є сумою трьох сил:
1) сила поверхневого натягу шару рідини (води), яка вистеляє альвеоли зсередини. Це основна сила, яка примушує альвеоли зменшувати свій розмір (а легені спадатися); вона складає 2/3 від всієї еластичної тяги легень.
2) сила напруження еластичних волокон, що входять до складу легеневої тканини.
3) тонус бронхіальної мускулатури – чим він вищий, тим вужчі дихальні шляхи і тим більший аеродинамічний опір, який дихальні шляхи надають руху повітря. При цьому еластична тяга легень збільшується.
В легенях існує спеціальний механізм, який зменшує силу поверхневого натягу альвеол. Він полягає в синтезі пневмоцитами ІІ типу сурфактанту – поверхнево-активної речовини (ПАР). Сурфактант вистелає альвеоли зсередини (на кордоні з повітряним середовищем). Сили взаємного відштовхування, які існують між молекулами сурфактанту, зменшують силу поверхневого натягу води. Сурфактант – речовина фосфоліпідної природи, виконує функції ПАР декілька годин, після чого потребує заміни. Речовини, що необхідні для синтезу сурфактанту, надходять до пневмоцитів з током крові, тому його вироблення порушується при порушенні кровопостачання легень.
Питома активність сурфактанту (тобто, його властивість зменшувати силу поверхневого натягу) залежить від товщини його шару на поверхні альвеоли – чим більша його товщина, тим більша питома активність. Тому, при зменшенні об’єму альвеоли сурфактант в більшій ступені знижує силу поверхневого натягу (товщина його шару збільшується) Ù попередження повного спадання альвеоли. При розтягненні альвеоли товщина шару сурфактанту зменшується Ù зниження його питомої активності Ù підвищення сили поверхневого натягу Ù попередження перерозтягу альвеол.
Таким чином, за рахунок зміни питомої активності сурфактанту при зміні розміру альвеол, здійснюється саморегуляція цього розміру Ù стабілізація альвеол.
Окрім основної функції сурфактант виконує ще й додаткові, такі як:
- зменшує роботу дихальних м’язів;
- попереджує випотівання рідини з альвеоли;
- очищає альвеоли (в звичайних умовах молекули сурфактанту рухаються по поверхні альвеол в напрямку до їх гирла).
3. Зовнішнє дихання. Показники зовнішнього дихання та їх оцінка.



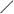

Основними методами дослідження показників зовнішнього дихання є спірометрія та спірографія.
Спірографія – метод графічної реєстрації дихальних рухів (в умовах спокійного та форсованого дихання).
Статичні показники зовнішнього дихання:
І. Об’єми:
1. ДО – дихальний об’єм – той об’єм повітря, який людина вдихає і видихає при спокійному диханні.
2. РО вдиху – резервний об’єм вдиху – той об’єм повітря, який людина може вдихнути при максимально глибокому вдосі понад ДО.
3. РО видиху – резервний об’єм видиху – той об’єм повітря, який людина може видихнути при максимально глибокому видосі понад ДО.
4. ЗО – залишковий об’єм – той об’єм повітря, який залишається в легенях після максимально глибокого видиху (його неможливо визначити методом спірографії чи спірометрії). Приблизно ЗО дорівнює 1200 мл.
ІІ. Ємності – показники зовнішнього дихання, які є сумою декількох об’ємів. До них відносяться:
1. ЖЄЛ – життєва ємність легень – сума РО вдоху, ДО та РО видиху – той об’єм повітря, який людина може вдихнути при максимально глибокому вдосі після максимально глибокого видиху (тобто, характеризує максимально можливу глибину дихання).
2. Є вдиху – ємність вдиху – сума РО вдоху і ДО – той об’єм повітря, який людина може вдихнути при максимально глибокому вдосі після спокійного видиху.
3. ФЗЄ – функціональна залишкова ємність легень – сума РО видиху і ЗО – той об’єм повітря, який залишається в легенях після спокійного видиху. ФЗЄ забезпечує постійний газообмін (в інтервалі між вдихом та видихом). Доволі висока величина ФЗЄ (2, 5 – 3л) є причиною того, що при вдосі газовий склад атмосферного повітря майже не змінюється (об’єм вдихуваного атмосферного повітря розподіляється в значному об’ємі альвеолярного повітря – ФОЕ).
4. ЗЄЛ – загальна ємність легень – той об’єм повітря, який міститься в легенях при максимально глибокому вдосі. Вона відповідає сумі РО вдоху, ДО, РО видиху та ЗО.
Всі статичні показники характеризують функціональні резерви системи зовнішнього дихання (тобто, можливості збільшити глибину вдоху, видиху і т.д.). у здорової людини їх величина залежить перш за все від стану (ступеня тренованості) дихальних м’язів. При патології статичні показники можуть змінюватися внаслідок порушення стану дихальних шляхів, тканини легень, грудної клітки.
Динамічні показники зовнішнього дихання по іншому називають показниками вентиляції легень. З врахуванням частоти дихальних рухів (ЧДР) і глибини дихання при спокійному та форсованому диханні вони показують, як проходить вентиляція легень при спокійному диханні і наскільки вона може зростати при форсованому диханні.
До динамічних показників, які характеризують спокійне дихання, відносять:
1. ХОД – хвилинний об’єм дихання. Його розраховують за формулою: ХОД = ДО 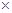 ЧДР. Він показує, який об’єм повітря проходить (вентилюється) через легені та дихальні шляхи за одну хвилину.
ЧДР. Він показує, який об’єм повітря проходить (вентилюється) через легені та дихальні шляхи за одну хвилину.
2. АВЛ – альвеолярна вентиляція легень – розраховується за формулою: АВЛ = (ДО – МП) 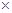 ЧДР, де МП – об’єм мертвого простору, який рівний приблизно 150 мл. АВЛ характеризує вентиляцію атмосферним повітрям альвеол (без врахування вентиляції дихальних шляхів). Цей показник більш інформативний, ніж ХОД.
ЧДР, де МП – об’єм мертвого простору, який рівний приблизно 150 мл. АВЛ характеризує вентиляцію атмосферним повітрям альвеол (без врахування вентиляції дихальних шляхів). Цей показник більш інформативний, ніж ХОД.
3. КВЛ – коефіцієнт вентиляції легень. Він розраховується за формулою: КВЛ = (ДО – МП): ФЗЄ, де (ДО – МП) – кількість (об’єм) атмосферного повітря, який потрапляє в альвеоли. Із ДО виключається МП, тому що спочатку, при вдосі, в альвеоли потрапляє повітря із дихальних шляхів (МП), який по складу не відрізняється від альвеолярного. КВЛ показує, яка частина альвеолярного повітря поновлюється при кожному вдосі. Виражається показник звичайним дробом і в нормі складає приблизно 1/7 – 1/8 (тобто, в нормі альвеолярне повітря при спокійному вдосі поновлюється на 1/7 – 1/8 частину).
До динамічних показників, які характеризують форсоване дихання, відносять:
1. МВЛ – максимальна вентиляція легень – максимально можливий при форсованому диханні ХОД. МВЛ розраховується за формулою: МВЛ = ДОmax 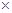 ЧДРmax. Максимальний дихальний об’єм і максимальну частоту дихальних рухів розраховують по спірограмі, яка записана в умовах форсованого дихання (кінцева частина спірограми).
ЧДРmax. Максимальний дихальний об’єм і максимальну частоту дихальних рухів розраховують по спірограмі, яка записана в умовах форсованого дихання (кінцева частина спірограми).
2. РД – резерв дихання, який розраховується за формулою: РД = МВЛ – ХОД. Тобто, цей показник говорить про те, на скільки літрів може збільшитися ХОД при форсованому диханні в порівнянні зі спокійним.
3. КРД – коефіцієнт резерву дихання, який розраховується за формулою: КРД = (МВЛ – ХОД): МВЛ 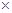 100%. В нормі цей показник рівний 85 – 90%.
100%. В нормі цей показник рівний 85 – 90%.
При аналізі динамічних показників зовнішнього дихання роблять висновок про реалізацію резервів зовнішнього дихання при спокійному та форсованому диханні.
Аналіз отриманих даних про величину статичних та динамічних показників проводять порівнюючи кожен показник з належним для даної піддослідної людини. Визначають належні величини показників зовнішнього дихання наступним чином:
1. Спочатку за таблицями Харіса та Бенедикта визначають належний (нормальний) для даної людини основний обмін. Таблиці різні для жінок та для чоловіків. Належний основний обмін визначають додаючи два числа:
- число А – число кілокалорій, що відповідає масі тіла людини;
- число Б – число кілокалорій, що відповідає віку та росту людини.
2. Далі переходять до таблиці належних показників зовнішнього дихання, де в рядку, який відповідає належному основному обміну людини, вказуються нормальні для неї показники зовнішнього дихання.
3. Отримані показники порівнюють з належними, розраховуючи відсоток відхилення отриманого показника від належного за формулою: % відхилення = ((отримана величина – належна величина): належна величина) 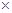 100%.
100%.
Якщо відхилення отриманого показника від належної величини не більше 15%, його величину рахують нормальною.
Метод спірометрії дозволяє визначити тільки статичні показники зовнішнього дихання, а саме: ДО, РО вдиху, РО видиху, ЖЄЛ.
Для роботи використовують сухоповітряний спірометр, який працює тільки на видосі. Статичні показники за його допомогою визначаються так:
1. ДО – роблять в спірометр 6 спокійних вдихів. Отриманий на шкалі об’єм ділять на 6 – таким чином ми усереднюємо результат і зменшуємо похибку.
2. РО вдиху – роблять в спірометр максимально глибокий видих після спокійного вдиху. Від об’єму, отриманого на шкалі приладу, необхідно відняти ДО.
3. ЖЄЛ – роблять в спірометр максимально глибокий видих після максимально глибокого вдиху і фіксують об’єм на шкалі.
4. РО видиху – можна визначити, віднявши від ЖЄЛ ДО і РО видиху.
Оцінку результатів проводять, порівнюючи їх з належними, які визначають з належним основним обміном (див. вище).
Метод пневмотрахометрії дозволяє визначити швидкість руху повітря при здійсненні вдиху та видиху. Дослідження проводиться шляхом вдихання чи видихання повітря через мундштук приладу. За положенням стрілки приладу визначають швидкість руху повітря.
При спокійному диханні швидкість руху повітряного потоку дорівнює 500 – 600 мл/с; при форсованому вдиху – 6000 – 8000 мл/с; при форсованому видиху – 4000 – 6000 мл/с.
Причиною зменшення показників можуть бути: збільшення опору руху повітря з боку дихальних шляхів (наприклад, при бронхіальній астмі), а також порушення зі сторони виконавчих структур, що забезпечують механіку вдиху та видиху (міозит, невралгії міжреберних нервів, плеврит і т.д.).
4. Анатомічний і фізіологічний " мертвий простір" його фізіологічна роль.
Частина альвеол, які вентилюються та не кровопостачаються, формують альвеолярний мертвий простір (в них не проходить газообмін і їх вентиляція неефективна, як і вентиляція дихальних шляхів). Сума анатомічного і альвеолярного мертвого простору називається фізіологічним (функціональним) мертвим простором. У здорової людини об’єм анатомічного і функціонального мертвого просторів мало відрізняються, та при деяких станах різниця може бути суттєвою.
5. Дифузія газів у легенях. Дифузійна здатність легень і фактори, від яких вона залежить.
Обмін газів (О2 та СО2) між альвеолярним повітрям та кров'ю проходить тільки пасивно за механізмом дифузії. Силою, яка спричиняє дифузію газів, являється різниця концентрації газів в альвеолярному повітрі та в венозній крові, яка надходить в капіляри легень.
Концентрація газів в повітрі характеризує їх парціальний тиск – та частина від загального тиску, що створюється сумішшю газів, яка приходиться на частку саме цього газу. Парціальний тиск (Р) розраховується, виходячи із загального тиску суміші газів і вмісту в ньому (в %) саме цього газу. Загальний тиск суміші газів, який називається атмосферним, видихуваним та альвеолярним повітрям, рівний атмосферному.
Концентрацію газу в крові характеризує його напруження – тиск газу, розчиненого в рідині. Напруження також позначається літерою Р.
Газовий склад вдихуваного (атмосферного), видихуваного та альвеолярного повітря різний:
| Повітря | О2 | СО2 | Азот та ін. гази. |
| Атмосферний | 20, 93% | 0, 03% | 79, 04% |
| Видихуваний | 16, 0% | 4, 5% | 79, 5% |
| Альвеолярний | 14, 0% | 5, 5% | 80, 5% |
Причиною різного газового складу атмосферного та видихуваного повітря є газообмін в легенях. Причиною різного газового складу видихуваного та альвеолярного повітря являється те, що видихуване повітря містить окрім альвеолярного ще й повітря із дихальних шляхів (мертвий простір, який не відрізняється за складом від атмосферного).
Площа дифузії в легенях (S) – це площа альвеол, які вентилюються та кровопостачаються. При різних функціональних станах у дорослої людини цей показник змінюється від 80 до 120 м2. Збільшення площі дифузії може зумовити збільшення глибини дихання і об’ємної швидкості кровотоку через судини легень, що має місце, наприклад, при фізичному навантаженні.
Товщина дифузного шару (L) у здорової людини складає 0, 4 – 1, 5 мкм. Дифузний шар (альвеоло-капілярна мембрана) включає в себе: шар сурфактанту, шар пневмоцитів, базальну мембрану альвеоли, шар ніжної сполучної тканини, базальну мембрану капіляра, шар ендотеліоцитів. В фізіологічних умовах товщина дифузного шару зменшується при збільшенні глибини дихання.
Коефіцієнт дифузії (К) є різним для різних газів і визначається їх здатністю розчинятися в структурах, які формують дифузний шар. За хімічним складом в цих структурах переважають фосфоліпіди (сурфактант, мембрани пневмоцитів та ендотеліоцитів, базальні мембрани) і вода. СО2 в фосфоліпідах та воді розчиняється набагато краще, ніж О2, тому коефіцієнт дифузії для вуглекислого газу приблизно в 20 разів більший, ніж для кисню.
Градієнт тисків (Р1 – Р2) в стані спокою складає близько 60 мм.рт.ст. для О2 (100 – 40) та близько 6 мм.рт.ст. для СО2 (46 – 40). Оскільки Ро2 та Рсо2 в альвеолах підтримуються на постійному рівні, градієнт тисків цих газів змінюються за рахунок зміни їх напруження в венозній крові.
Таким чином, в стані спокою градієнт тисків, за яким йде дифузія О2, в 10 разів більше градієнта, за яким іде дифузія СО2. Та об’єм дифузії цих газів відрізняється на незначну кількість. Протягом однієї хвилини в стані спокою дифундує 250 – 300 мл. О2 і лише дещо менше СО2 (200 – 250 мл). Великий об’єм дифузії СО2 при порівняно невисокому градієнту тисків пов’язаний з високим коефіцієнтом дифузії цього газу.
Об’єм дифузії О2 і СО2 при фізичному навантаженні збільшується до десяти разів в порівнянні з станом спокою. Це пов’язано з збільшенням площі дифузії та зменшенням товщини дифузного шару, з збільшенням градієнту тисків газів по обидві сторони альвеоло-капілярної мембрани (за рахунок зміни газового складу венозної крові).
В клініці та експерименті за життя неможливо визначити площу дифузії і товщину дифузного шару. Тому для характеристики процесів дифузії в легенях ввели поняття дифузної здатності легень (ДЗЛ) – об’єм газу, який дифундує через альвеоло-капілярну мембрану за 1 хвилину при градієнті тиску цього газу по обидві сторони альвеоло-капілярної мембрани, що рівний 1 мм.рт.ст. Таким чином, визначають ДЗЛ шляхом поділу об’єму дифузії газу за одну хвилину на градієнт тисків цього газу в альвеолах і в крові.
ДЗЛ прямопропорційна площі дифузії, коефіцієнту дифузії даного газу, оберненопропорційна товщині дифузного шару і не залежить від градієнту тисків газу (дане визначення випливає, якщо замість V в формулі для визначення ДЗЛ підставити формулу з закону Фіка для визначення об’єму дифузії газу). ДЗЛ для О2 в стані спокою у дорослої людини складає близько 25 – 30 мл/хв 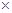 мм.рт.ст.
мм.рт.ст.
В стані спокою час, протягом якого кров знаходиться в капілярах легень, складає 0, 75 – 1, 0с. Час, протягом якого проходить вирівнювання вмісту О2 в альвеолярному повітрі і в крові – близько 0, 25с. Тобто, вміст газів в крові, відтікаючої від альвеоли, дорівнює такому в альвеолі. Така ж ситуація зберігається і при фізичному навантаженні – час проходження крові через капіляри легень скорочується до 0, 25с, але все ж залишається достатнім для вирівнювання вмісту газів в крові та в альвеолярному повітрі. Тільки при дуже значному підвищенні лінійної швидкості руху крові в капілярах, її газовий склад не встигає досягнути параметрів альвеолярного повітря.
Та навіть в стані спокою має місце альвеоло-артеріальний градієнт тиску для О2 та СО2 – напруження кисню в артеріальній крові на 5 – 10 мм.рт.ст. нижче, а напруження вуглекислого газу на 1 – 2 мм.рт.ст. вище, ніж в альвеолярному повітрі (Ро2 = 100 мм.рт.ст., Рсо2 = 40 мм.рт.ст. в альвеолах; Ро2 = 90 – 95 мм.рт.ст., Рсо2 = 41 - 42 мм.рт.ст. в артеріальній крові). Причиною наявності альвеоло-артеріального градієнту тисків газів являється:
1. Наявність артеріо-венозних шунтів, по яким в артеріальну кров “скидається” венозна. В якості таких шунтів виступають:
- судини, що забезпечують живлення бронхіального дерева і легень;
- вени Тебехія, по яким венозна кров від серця надходить в ліві його відділи;
- капіляри, за якими рухається кров через невентильовані альвеоли.
2. Нерівномірність вентиляції і перфузії (кровотоку) в легенях. Для легенів в цілому відношення вентиляції до перфузії (АВЛ до ХОК) складає близько 0, 8.
При такому рівні ВПВ (вентиляційно-перфузійних відношень) Ро2 в альвеолах рівняється 100 мм.рт.ст., а Рсо2 – 40 мм.рт.ст. Та такий рівень ВПВ має місце тільки в альвеолах середніх сегментів легень, в верхівках і в базальних сегментах легень ВПВ інше.
Причина полягає в тому, що в легенях має місце:
а) нерівномірність вентиляції: краще всього вентилюються базальні сегменти легень, менше – середні сегменти, найбільш погано – верхівки легень. Причина нерівномірності вентиляції заключається в тому, що верхівки легень розтягнені силою тяжіння вже в стані видиху, тому їх здатність до розтягнення нижча і на той же приріст транспульмонального тиску вони менше збільшують свій об’єм Ù гірше вентилюються.
б) нерівномірність перфузії: артеріальні судини легень мають дуже високу здатність до розтягнення (як і венозні), тому кровотік в них в значній мірі залежить від впливу фактора гравітації – від серця основна маса крові під впливом сили тяжіння направляється до базальних сегментів легень, менша – до середніх, сама мала – до верхівок.
Та ступінь нерівномірності вентиляції і кровотоку різна. Нерівномірність кровотоку виражена набагато більше, ніж нерівномірність вентиляції. Тому ВПВ змінюється в нвпрямку від верхівок до базальних сегментів легень:
- в верхівках знижена вентиляція і кровотік, та більша ступінь зниження кровотоку призводить до підвищення ВПВ Ù переважання вентиляції Ù зміна газового складу альвеолярного повітря (збільшення Ро2 і зниження Рсо2) Ù аналогічна зміна газового складу відтікаючої від цих альвеол крові, тобто, кров, відтікаюча від верхівок, має Ро2 більше 100 мм.рт.ст., а Рсо2 менше 40 мм.рт.ст.;
- в середніх сегментах легень ВПВ = 0, 8 Ù Ро2 в альвеолах (і крові) складає 100 мм.рт.ст., Рсо2 – 40 мм.рт.ст.;
- в базальних сегментах легень переважає кровотік, ВПВ = 0, 7 – 0, 6, тому Ро2 в альвеолах (і крові) менше 100 мм.рт.ст., а Рсо2 – більше 40 мм.рт.ст.
Всі роздуми, що були наведенні вище, торкаються вертикальної пози людини. Оскільки при цьому основна маса крові направляється до базальних сегментів легень, де ВПВ = 0, 8, в артеріальній крові, що відтікає від легень до лівого серця Ро2 = 100 мм.рт.ст., а Рсо2 = 40 мм.рт.ст.
Внесок названих факторів (артеріо-венозного шунтування та нерівномірності ВПВ) в створення альвеоло-артеріальних градієнтів Ро2 та Рсо2 приблизно рівний.
6. Транспорт кисню кров’ю. Киснева ємкість крові.
Кисень транспортується кров’ю у двох формах:
1. Розчинений у плазмі крові. При РСО2 =100 мм.рт.ст. в 1л крові розчиняється 3 мл кисню.
2. В хімічно зв’язаному з гемоглобіном стані – у вигляді оксигемоглобіну. Це основна форма транспорту кисню – 1г гемоглобіну за оптимальних умов може зв’язати 1, 34 мл кисню. Виходячи з цього розраховують кисневу ємкість крові – максимальну кількість О2 , котру може зв’язати 1л крові. КЄК при концентрації гемоглобіну 150 г/л складає 200мл/л, або 20% об’ємних.
7. Крива дисоціації оксигемоглобіну, фактори, що впливають на її хід.
Здатність гемоглобіну реагувати з киснем характеризує крива дисоціації оксигемоглобіну (КДО). При її побудові на осі абсцис відкладують РО2 (мм.рт.ст), по осі ординат – відсотковий вміст оксигемоглобіну в крові. Будують КДО мінімум за двома точками:
- при РО2 = 100 мм.рт.ст. гемоглобін насичений киснем на 98%;
- при РО2 = 60 мм.рт.ст. насичення О2 складає 90%;
- при РО2 = 26 мм.рт.ст. насичення гемоглобіну киснем – 50%.
- при РО2 = 0, насичення гемоглобіну = 0%.
Характерно, що при високому РО2 гемоглобін легко взаємодіє з киснем – утворення HbO2 (верхня, полога – " горизонтальна" частина кривої). Зниження РО2 зі 100 до 60 мм.рт.ст мало впливає на утворення НbO2 – його концентрації зменшується лише на 8%. Це означає, що зниження тиску кисню в альвеолах до 60 мм.рт.ст мало вплине на транспорт кисню кров’ю, хоча напруження кисню в плазмі буде знижуватися пропорційно зниженню тиску О2 в альвеолах. Завдяки такій особливості ходу КДО, ми можемо, наприклад, підійматися в гори – не зважаючи на істотне зниження атмосферного тиску, постачання тканин киснем зберігається на потрібному рівні.
Коли парціальний тиск О2 в атмосфері високий, реакція
Hb + O2 = HbO2
зсунута в бік утворення оксигемоглобіну. В умовах цілісного організму такі умовистворюються при проходженні крові капілярами легень.
Зниження Ро2 нижче 60 мм.рт.ст. супроводжується значним зниженням HbO2 в крові – він активно дисоціює з утворенням гемоглобіну та вільного кисню. В умовах цілісного організму це відбувається в тканинах (рівень Ро2 складає 50-20 мм.рт.ст.). І що активніше функціонує тканина, тим нижчий в ній рівень О2 – посилена дисоціація HbO2 з вивільненням молекулярного кисню, котрий утилізується тканинами. Тобто, за цих умов реакція взаємодії кисню та гемоглобіну зсунута в бік дисоціації оксигемоглобіну.
Отже, S-подібна форма кривої дисоціації оксигемоглобіну відображає компроміс між необхідністю активно зв’язувати кисень у атмосфері з високим парціальним тиском його (капіляри легень) та легко віддавати кисень в атмосфері з низьким парціальним тиском (капіляри тканин).
Спорідненість кисню та гемоглобіну і хід КДО залежать від кількох чинників. Деякі з них знижують цю спорідненість; прицьому гемоглобін легше віддає кисень, а КДО зсувається праворуч. Видно, що при зсуві КДО праворуч при тому ж рівні парціального тиску кисню розпадається більше оксигемоглобіну. До чинників, що зсувають КДО праворуч належать:
- накопичення вуглекислоти (взаємодіє з глобіновою частиною Нb – зниження його спорідненості до кисню);
- накопичення йонів водню (протонів – зниження рН) – протони також взаємодіють з глобіном – зниження спорідненості кисню і Hb;
- підвищення температури.
Усі ці цинники впливають на оксигемоглобін в тканинах, що активпо працюють – саме там накопичуються вуглекислота, протони, підвищується температура (через посилений метаболізм). Це призводить до зменшення спорідненості Hb і О2 – посилення дисоціації оксигемоглобіну – посилене утворення молекулярного кисню, котрий необхідний тканинам, що активно функціонують.
Ще одним чинником, котрий зсуває КДО праворуч є підвищення концентрації 2, 3-дифосфогліцерату (2, 3-ДФГ) в еритроцитах. Ця сполука є продуктом вуглеводного обміну (гліколіз). А оскільки основним джерелом енергії для еритроцитів є анаеробний гліколіз, то 2, 3-ДФГ виникає при гіпоксії. 2, 3-ДФГ взаємодіє з глобіном – спричиняє аналогічний з попередніми сполуками ефект – покращує постачання тканин киснем.
Зсув КДО ліворуч відповідає підвищенню спорідненості гемоглобіну до кисню – при тому ж рівні парціального тиску О2 кількість оксигемоглобіну буде більшою. Зсув КДО ліворуч викликають:
- зниження концентрації вуглекислоти;
- підвищення рН;
- зниження температури;
- зниження вмісту 2, 3-ДФГ в еритроцитах.
Отже, чинниками, котрі впливають на зв’язування і передачу кисню кров’ю є:
- вміст гемоглобіну в крові (прямопропорційний до зв’язувальної здатності крові);
- парціальний тиск кисню (при високому тиску переважно зв’язує кисень, при високому - віддає);
- вміст вуглекислоти;
- рН;
- температура;
- концентрація 2, 3-ДФГ;
Коефіцієнт утилізації кисню (КУО2) характеризує віддачу кисню тканинам.
Виражають КУО2 в процентах. У стані спокою він складає 30-35%, тобто тканини споживають 30-35% кисню, що міститься в артеріальній крові. При фізичному навантаженні КУО2 збільшується; при дуже інтенсивній роботі він складає 70-75%. Цьому сприяють:
- зниження Ро2 в тканинах, що активно функціонують;
- накопичення в цих тканинах вуглекислоти;
- накопичення в них протонів;
- підвищення в них температури.
Завдяки підвищенню утилізації кисню при фізичному навантаженні зростає артеріо-венозна різниця кисню. У спокої вміст О2 в артеріальній кровіблизько 200 мл/л, у венозній – 130-140 мл/л. Тобто артеріо-венозна рязниця складає 60-70мл/л. При фізичному навантаженні вміст О2 в артеріальній крові зростає незначно (вихід крові з депо і згущеня її в одиниці об’єму дещо підвищує концентрацію гемоглобіну). В той же час істотно знижується вміст О2 у венозній крові за рахунок посиленої його віддачі; вміст О2 прицьому у венозній крові може знижуватися до 60-70 мл/л. За таких умов артеріо-венозна різниця зростає до 130-140 мл/л.
8. Транспорт вуглекислого газу кров'ю. Роль еритроцитів в транспорті вуглекислого газу.
Вуглекислий газ транспортується наступними шляхами:
1. Розчинений у плазмі крові – близько 25 мл/л.
2. Зв’язаний з гемоглобіном (карбгемоглобін) – 45 мл/л.
3. У вигляді солей вугільної кислоти – букарбонати каліі та натрію плазми крові – 510 мл/л.
Таким чином, у стані спокою кров транспортує 580 мл вуглекислого газу в 1 л. Отже, основною формою транспорту СО2 є бікорбонати плазми, що утворюються завдяки активному протіканню карбоангідразної реакції.
В еритроцитах міститься фермент карбоангідраза (КГ), котрий каталізує взаємодію вуглекислого газу із водою з утворенням вугільної кислоти, що дисоціює з утворенням бікарбонатного йона та протона. Бікарбонат всередині еритроцита взаємодіє з йонами калію, що виділяються з калієвої солі гемоглобіну при відновленні останнього. Так всередині еритроцита утворюється бікарбонат калію. Але бікарбонатні йони утворюються в значній концентрації і тому за градієнтом концентрації (в обмін на йони хлору) надходять у плазму крові. Так у плазмі утворюється бікарбонат натрію. Протон, що утворився при дисоціації вугільної кислоти, реагує з гемоглобіном з утворенням слабкої кислоти ННb.
В капілярах легень ці процеси йдуть в зворотньому напрямку. З йонів водню та бікарбонатних йонів утворюється вугільна кислота, котра швидко розпадається на вуглекислий газ та воду. Вуглекислий газ видаляється назовні.
Отже, роль еритроцитів у транспорті вуглекислоти така:
- утворення солей вугільної кислоти;
- утворення карбгемоглобіну.
Дифузія газів в тканинах підкоряється загальним законам (об’єм дифузії прямопропорційний площі дифузії, градієнту напруження газів в крові та тканинах). Площа дифузії збільшується, а товщина дифузного шару зменшується під час збільшення кількості функціонуючих капілярів, що має місце при підвищенні рівня функціональної активності тканин. В цих же умовах зростає градієнт напруження газів за рахунок зниження в активно працюючих органах Ро2 та підвищення Рсо2 (газовий склад артеріальної крові, як і альвеолярного повітря залишається незмінним!!!). Всі ці зміни в активно працюючих тканинах сприяють збільшенню об’єму дифузії О2 та СО2 в них. Споживання О2 (СО2) за спірограмою визначають по зміні (зсуву) кривої вверх за одиницю часу (1 хвилину).
9. Фізіологічна роль дихальних шляхів, регуляція їх просвіту.
Дихальні шляхи виконують дуже важливу функцію – кондиціювання повітря. Завдяки цьому в легені надходить повітря тільки певних параметрів. В дихальних шляхах повітря:
- зігрівається;
- зволожується, тому повітря в легенях насичене водяними парами на 100%, незалежно від вологості атмосферного повітря;
- очищується, завдяки наявності війчастого епітелію та бокалоподібних клітин, які секретують слиз (рух війок забезпечує проходження слизу і осівших на поверхні дихальних шляхів чужорідних частинок, мікроорганізмів в напрямку гортані та глотки, де вони проковтуються або відхаркуються), частина осівших на поверхні дихальних шляхів мікроорганізмів і частинок знешкоджуються макрофагами.
Окрім того, повітроносні шляхи мають велику кількість рецепторів (є рефлексогенною зоною), що забезпечує їх участь в здійсненні захисних дихальних рефлексів.
В регуляції величини просвіту дихальних шляхів (і їх опору руху повітря) приймають участь, головним чином, нервові механізми. При цьому парасимпатичні рефлекторні впливи супроводжуються скороченням гладких м’язів Ù звуження дихальних шляхів. В гладких м’язах дихальних шляхів є a- та b-адренорецептори; стимуляція b-адренорецепторів супроводжується розслабленням гладких м’язів повітроносних шляхів і розширенням бронхіол, а стимуляція a-адренорецепторів – напруженям гладких м’язів та звуженням бронхів. В гладких м’язах дихальних шляхів переважають b-адренорецептори, тому в умовах підвищення активності симпато-адреналової системи просвіт дихальних шляхів розширюється Ù створюються оптимальні умови для вентиляції легень.
10. Дихальний центр, його будова, регуляція ритмічності дихання.
Регуляція зовнішнього дихання здійснюється шляхом ритмічного чергування вдиху та видиху. Вдих та видих проходять завдяки скорочення та розслаблення скелетних м’язів. Скорочення та розслаблення їх регулюється тільки за допомогою нервових механізмів (соматичних рефлексів). Зміна зовнішнього дихання зводиться до зміни глибини дихання (величини ДО) та його частоти (ЧДР) Ù зміна вентиляції легень Ù підтримання постійного газового складу альвеолярного повітря не дивлячись на зміну функціонального стану організму.
Дихальний центр (ДЦ) знаходиться в задньому мозку (довгастий мозок та міст), хоча в регуляції зовнішнього жихання приймають участь всі рівні ЦНС, аж до кори головного мозку. Локалізація ДЦ визначається в дослідах з перерізкою стовбуру мозку.
Таким чином, перерізка стовбуру вище заднього мозку не супроводжується змінами дихання, а перерізка нижче довгастого мозку призводить до його зупинки Ù ДЦ знаходиться саме в задньому мозку. Та він має складну структуру, тому що перерізки на різних рівнях заднього мозку призводить до різних порушень дихальної ритміки (апнейзіс – глибоке дихання з затримкою на вдосі; гаспінг – глибоке дихання з затримкою на видосі). В верхній третині мосту знаходиться пневмотаксичний центр (ПТЦ), який припиняє вдих та забезпечує поступовий перехід вдиху до видиху (перерізка стовбура на цьому рівні призводить до розвитку апнейстичного дихання).
Дихальний центр довгастого мозку має два ядра – дорсальне та вентральне (розміщені симетрично по відношенню до середньої лінії).
Особливістю дорсального ядра є наявність в ньому тільки інспіраторних нейронів, які збуджуються безпосередньо перед вдихом та під час вдиху (інспіраторні нейрони або нейрони вдиху). Нейрони дорсального дихального ядра забезпечують регуляцію дихання в стані спокою (при цьому акт вдиху є активним, а видиху – пасивним). Збудження інспіраторних нейронів дорсального ядра забезпечує скорочення м’язів спокійного вдиху Ù вдих Ù гальмування інспіраторних нейронів дорсального ядра Ù розслаблення м’язів Ù пасивний видих.
До складу вентрального ядра входять як інспіраторні так і експіраторні нейрони (нейрони видиху). Це ядро вмикається в регуляцію форсованого (глибокого): дихання інспіраторні нейрони вентрального ядра забезпечують скорочення м’язів форсованого вдоху; експіраторні – м’язів видиху.
Еферентні зв’язки нейронів дорсального ядра (інспіраторних) здійснюються таким чином: від цих нейронів по ретикулоспінальних шляхах інформація передається до мотонейронів спинного мозку:
- які локалізуються в ІІІ – ІV сегментах шийного відділу спинного мозку; аксони цих нейронів формують діафрагмальний нерв Ù передача інформації до діафрагми;
- які локалізуються в усіх сегментах грудного відділу Ù до зовнішніх міжреберних м’язів.
Інспіраторні нейрони вентрального дихального ядра передають інформацію до мотонейронів спинного мозку, які інервують додаткові м’язи вдиху, експіраторні – до мотонейронів, які інервують м’язи видиху.
Механізм ритмічного чергування вдиху та видиху в стані спокою пов’язаний з ритмічним збдженням та гальмуванням інспіраторних нейронів дорсального ядра дихального центру.
Збудження цих нейронів головним чином зумовлюється надходженням до них інформації від хеморецепторів (ХР) (центральних і периферичних), які є тонічно активними: генерують ПД навіть при повністю нормальному газовому складу артеріальної крові та ліквора. Збудження від цих інспіраторних нейронів передається до мотонейронів спинного мозку Ù збудження та скорочення дихальних м’язів Ù вдих.
Далі збудження інспіраторних нейронів дорсального ядра змінюється їх гальмуванням. Цьому сприяє надходження до них інформації від таких структур:
1. Від рецепторів розтягнення легень (РРЛ) по аферентних волокнах блукаючого нерва Ù спочатку до гальмівних вставних нейронів (ГВН) Ù до інспіраторних нейронів;
2. Від пневмотаксичного центру (ПТЦ), збудження якого при вдосі пов’язане з надходженням до нього інформації від інспіраторних нейронів, а також від інших нейронів (ПТЦ – частина ретикулярної формації стовбура мозку і його аферентні зв’язки різноманітні). Коли потік гальмівної інформації від РРЛ та від ПТЦ до інспіраторних нейронів стає більш потужнішим, ніж потік збуджуючої інформації від хеморецепторів, інспіраторні нейрони гальмуються Ù гальмування мотонейронів спинного мозку Ù розслаблення дихальних м’язів Ù видих.
Видих знімає механізми, які активують РРЛ та ПТЦ Ù припинення надходження гальмівної інформації до інспіраторних нейронів Ù переважання аферентного входу від ХР Ù збудження інспіраторних нейронів Ù видих.
11. Механізм першого вдиху новонародженої дитини.
1. Після перерізки пуповини в крові дитини накопичується вуглекислота, знижується рН крові та знижується парціальний тиск кисню – стимуляція центральних та периферичних хеморецепторів – збудження дихального центру – збудження інспіраторних нейронів – скорочення м’язів вдиху.
2. Стимулювати перший вдих новонародженого можна дією на різні рецептори, оскільки аферентна інервація дихального центру дуже різноманітна:
- стимулюючи терморецептори – раніше дитину опускали то в холодну то в теплу воду;
- діючи на механорецептори (поплескування, пощипування шкіри);
- діючи на вестибулорецептори – дитину можна опускати головою вниз, нахиляти зі сторони в сторону.
3. Після народження дитини треба зняти “рефлекс пірнальника”, котрий блокує настання вдиху через наявність рідини в дихальних шляхах. Щоб зняти цей рефлекс цю рідину періодично аспірують.
12. Роль рецепторів розтягнення легень та блукаючих нервів в регуляції дихання.
Рецептори розтягнення легень збуджуються у відповідь на розтягнення легенів при вдосі, особливо при глибокому. Інформація від цих рецепторів передається в дихальний центр по аферентних волокнах блукаючого нерва і через гальмівні вставні нейрони гальмує інспіраторні нейрони Ù видих. Таким чином, за участю цих рефлексів, які починаються з подразнення цих рецепторів при вдосі, вдих припиняється і наступає видих. Ці рефлекси носять назву рефлексів Герінга-Брайера. Вони приймають участь в саморегуляції ритму дихання. Цим і визначається роль блукаючих нервів в забезпеченні ритму дихання.
Варто відзначити, що до рецепторів, які знаходяться в легенях та в дихальних шляхах, і які беруть участь в регуляції дихання відносяться:
- ірритантні рецептори легень, які реагують на дію їдких газів, пилу, тютюнового диму, холодного повітря і при збудженні зумовлюють звуження бронхів і гіпервентиляцію;
- юкстакапілярні рецептори, що розміщуються поблизу капілярів легень і реагують на зміну механічних властивостей легеневої тканини (набряк, переповнення капілярів кров’ю і т.д.) Ù тахіпное;
- рецептори дихальних шляхів, що реагують на механічні та хімічні подразники і спричиняють виникнення захисних дихальних рефлексів (кашель, чхання, звуження бронхів).
- пропріорецептори працюючих м’язів, інформація від яких стимулює зовнішнє дихання (рефлекторно) при фізичному навантаженні;
- пропріорецептори дихальних м’язів – забезпечують рефлекторну саморегуляцію дихання при зміні опору (на вдиху чи на видиху).
- артеріальні пресорецептори, які реагують на підвищення САТ Ù гіповентиляція. Протилежні реакції спостерігаються при зниженні САТ;
- вольові температурні рецептори – їх стимуляція призводить до різноманітних змін в акті дихання.
13. Роль центральних і периферичних хеморецепторів в регуляції дихання. Компоненти крові, що стимулюють зовнішнє дихання.
Дуже важливим є аферентий вплив на ДЦ хеморецепторів, які поділяються на центральні та периферичні:
Периферичні хеморецептори локалізуються в судинних рефлексогенних зонах (дуга аорти і каротидні синуси). В регуляції дихання більш важливими є каротидні хеморецептори. Адекватні подразники для них:
- збільшення Рсо2 артеріальної крові;
- зменшення рН артеріальної крові;
- зменшення Ро2 артеріальної крові.
Інформація, що надходить до дихального центру при підвищенні активності цих рецепторів, викликає гіпервентиляцію (підвищення глибини та частоти дихання) Ù нормалізація вказаних показників крові. Тобто, за їх участю здійснюється регуляція газового складу артеріальної крові за відхиленням (саморегуляція на основі негативного зворотнього зв’язку).
Центральні хеморецептори локалізуються на вентральній поверхні довгастого мозку (дно ІV шлуночка) і омиваються ліквором. Адекватними подразниками для цих рецепторів є:
- збільшення Рсо2 ліквора;
- зменшення рН ліквора.
Підвищення активності цих рецепторів, як і периферичних, призводить до розвитку гіпервентиляції Ù нормалізація вказаних показників ліквора.
Таким чином, периферичні хеморецептори, на відміну від центральних реагують на зниження Ро2 артеріальної крові. Тому гіпоксія стимулює зовнішнє дихання тільки за рахунок рефлексів, які розпочинаються з подразнення периферичних хеморецепторів. Та в цілому в регуляції зовнішнього дихання велике значення мають рефлекси, що пов’язані зі стимуляцією центральних хеморецепторів (співвідношення ролі центральних та периферичних хеморецепторів складає приблизно 4: 1). Однак зміна Рсо2 і рН ліквора виникають пізніше, ніж артеріальної крові. Тому рефлекси з центральних хеморецепторів вмикаються в регуляцію зовнішнього дихання пізніше, ніж рефлекси з периферичних хеморецепторів.
Таким чином, не дивлячись на велику роль в регуляції зовнішнього дихання центральних хеморецепторів, периферичні хеморецептори:
- забезпечують більш швидкі рефлекторні відповіді;
- тільки вони реагують на гіпоксію Ù стимуляція зовнішнього дихання в умовах гіпоксії.
До компонентів крові, які стимулюють зовнішнє дихання, відносяться Ро2, рН, Рсо2. Найбільшого значення для регуляції зовнішнього дихання має вміст в крові СО2 (Рсо2), менше – вміст йонів Н+, саме менше – вміст О2 (Ро2).
Залежність вентиляції легень від Рсо2 досліджують при диханні газовою сумішшю, в якій Ро2 залишається незмінним а Рсо2 поступово підвищується. При цьому відмічено, що підвищення Рсо2 в газовій суміші на 1 мм.рт.ст. супроводжується підвищенням ХОД на 2 – 3л/хв. При підвищенні Рсо2 артеріальної крові від 40 до 60 мм.рт.ст. ХОД зростає від 7 до 65 л/хв. Підвищення ХОД у відповідь на підвищення Рсо2 проходить лише до певної межі. Якщо Рсо2 в артеріальній крові стає вищим від 70 мм.рт.ст., ХОД знижується, що є результатом прямого пригнічуючого впливу СО2 на нейрони дихального центру.
При зниженні рН артеріальної крові нижче 7, 4 вентиляція легень (ХОД) також підвищується. Зменшення рН на 0, 1 призводить до збільшення ХОД на 2 л/хв. Гіпервентиляція при збільшенні концентрації йонів Н+ супроводжується зниженням Рсо2 в крові. Тому, якщо дослідження проводити при постійному Рсо2 в артеріальній крові (40 мм.рт.ст.), гіпервентиляція виражена більше (заштрихована лінія).
Зниження Ро2 в артеріальній крові також супроводжується гіпервентиляцією. Звертає на себе увагу той факт, що вплив зниження Ро2 впливає на ХОД, якщо величина показника стає нижчою за 50 – 60 мм.рт.ст. (норма – 100 мм.рт.ст.). тобто, гіпервентиляція розвивається у відповідь на значне зниження Ро2 і ступінь її невелика. Як і в випадку з рН, реакція стає більш вираженою, якщо при дослідженні стабілізувати Рсо2 на рівні 40 мм.рт.ст. (заштрихована лінія).
Таким чином, підвищення Рсо2 призводить до гіпервентиляції відразу ж (тобто, при збільшенні показника на 1 – 2 мм.рт.ст.) і ступінь гіпервентиляції є значною. Гіпоксія стимулює зовнішнє дихання тільки при значному зниженні Ро2 (до 50 – 60 мм.рт.ст.) і ступінь гіпервентиляції при цьому не значна.
Тому головним стимулятором зовнішнього дихання є підвищення Рсо2 в артеріальній крові, а зниження Ро2 в фізіологічних умовах рідко виступає як стимулятор зовнішнього дихання (наприклад, при підйомі в гори), та часто стає ним в умовах патології.
14. Регуляція зовнішнього дихання при фізичному навантаженні.
При фізичному навантаженні розвивається гіпервентиляція, ступінь якої пропорційна інтенсивності навантаження. Регуляція зовнішнього дихання в цих умовах здійснюється як по збуренню (ведучий механізм) так і по відхиленню (в умовах дуже інтенсивного або довготривалого навантаження).
Головним механізмом розвитку гіпервентиляції при фізичному навантаженні є безумовні рефлекси з пропріорецепторів працюючих м’язів (керуючий пристрій (КП), яким є дихальний центр, отримує по каналу зовнішнього зв’язку інформацію від пропріорецепторів працюючих м’язів про роботу що виконується; КП аналізує цю інформацію і викликає підвищення глибини та частоти дихання для того, щоб при збільшених метаболічних потребах тканин склад альвеолярного повітря залишався незмінним).
Рецептори з пропріорецепторів працюючих м’язів є ведучим, та не єдиним механізмом, який стимулює розвиток гіпервентиляції при фізичному навантаженні. Ще до початку роботи гіпервентиляція може розвиватися за механізмом умовних рефлексів (передстартові стани у спортсменів).
Від моторної зони кори ГМ паралельно з передачею команди про початок роботи до скелетних м’язів, інформація надходить і до нейронів дихального центру, що також сприяє розвитку гіпервентиляції.
Гіпервентиляція, яка розвивається внаслідок вмикання всіх вищеназваних механізмів, рідко точно відповідає метаболічним потребам організму, частіше вона буває дещо надмірною або недостатньою (дихальному центру “важко” точно оцінити сигнали, які до нього надходять з точки зору інтенсивності м’язевої роботи, а значить і метаболізму). Якщо рівень вентиляції не зовсім відповідає рівню метаболізма, проходить зміна газового складу артеріальної крові. Ці відхилення сприймаються хеморецепторами (центральними та периферичними – СП1) Ù передача інформації в КП каналом зворотнього зв’язку зміна вентиляції; вона стає відповідати рівню метаболізма Ù нормалізація газового складу артеріальної крові. Таким чином, хеморецептори виступають як детектори похибки і вносять необхідні корективи (рефлекторно) в роботу дихального центру при фізичному навантаженні.
І лише при роботі дуже інтенсивній чи довготривалій, коли система зовнішнього дихання не може забезпечити підтримання постійності газового складу в альвеолярному повітрі (і в артеріальній крові), рефлекси з хеморецепторів виступають як механізми стимуляції зовнішнього дихання.
15. Методи визначення енерговитрат людини. Дихальний коефіцієнт. Джерела і шляхи використання енергії в організмі людини.
З точки зору термодинаміки, організм людини є відкритою термодинамічною системою, тобто він обмінюється з навколишнім середовищем речовиною, енергією та інформацією.
Як будь-яка термодинамічна система, організм людини підкоряється законам термодинаміки:
1-й закон: загальна енергія системи та навколишнього середовища постійна, та в ході хімічних реакцій та фізичних процесів енергія може переходити із однієї форми в іншу. Тобто, 1-й закон термодинаміки представляє собою закон збереження енергії.
2-й закон: всі самовільні процеси намагаються проходити в напрямку зростання ентропії системи та навколишнього середовища. Ентропія – міра невпорядкованості системи, міра деструкції та розсіяності енергії. Тобто, 2-й закон обмежує можливі самовільні перетворення енергії в системі.
У відповідності з другим законом термодинаміки всі самовільні процеси в організмі проходять в напрямку підвищення ентропії, тобто зменшення ступеня впорядкованості структур, які складають організм. Та організм людини, як і будь-який інший організм характеризується високою ступінню впорядкованості структур. Підтримання такої впорядкованості структур можливе тільки завдяки постійному обміну енергією з зовнішнім середовищем.
Надходження енергії в організм людини проходить у вигляді енергії хімічних зв’язків харчових продуктів (жирів, білків та вуглеводів).
Перетворення енергії в організмі людини полягає в її:
- вивільненні;
- акумуляції;
- використанні.
Виділення енергії з організму людини проходить у вигляді тепла (за умові, що людини не виконує зовнішньої механічної роботи, бо при її виконанні частина енергії виділяється із організму у вигляді тепла, а частина іде на виконання роботи).
Перетворення енергії в організмі людини:
1. Вивільнення енергії.
2. Акумуляція енергії.
3. Використання енергії.
Виділення енергії з організму людини відбувається у вигляді тепла (за умови що людина не виконує жодної зовнішньої механічної роботи – тоді частина енергії виділяється у вигляді тепла, а частина йде на виконання роботи).
Перетворення енергії в організмі людини.
1. Вивільнення енергії поживних речовин відбувається при руйнуванні їх хімічних зв’язків. В організмі людини основну роль в процесах вивільнення енергїі відіграють процеси аеробного окисного фосфорилювання. Пари електронів, що вивільняються при окисненні субстратів циклу Кребса, при окисненні жирних кислот передаються на ансамбль ферментів, що називається дихальним ланцюгом. При транспорті електронів по дихальному ланцюгу зменшується їх вільна енергія. При цьому:
- частина енергії перетворюється на тепло (первинне) і виділяється з організму; ця частина складає 50-60% від усієї енергії окиснення;
- решта енергії йде на синтез АТФ з АДФ та неорганічного фосфату.
Ступінь спряження окиснення та фосфорилювання в дихальному ланцюзі характеризує відношення Фн/О2, максимальна величина якого теоретично може досягати 3 – при витраті одного атома кисню максимально може утворитися 3 молекули АТФ і витратитися 3 атоми неорганічного фосфору. Ступінь спряження окиснення і фосфорилювання може змінюватися під впливом гормонів (катехоламінів, тироксину), при активізації симпатичного відділу вегетативної нервової системи. Вони розділяють окиснення й фосфорилювання в дихальному ланцюзі Ù більша частина енергії перетворюється на первинне тепло і менше її йде на синтез АТФ. Якщо енарговитрати організму при цьому не змінилися (для підтримки життєдіяльності та виконання роботи потрібно стільки ж енергії, як і до розділення окиснення й фосфорилювання), інтенсивність аеробного окиснення буде зростати (для синтезу такої ж кількості АТФ потрібно окиснити більше поживних речовин).
2. Акумуляція енергії відбувається у вигляді енергії макроергічних зв’язків АТФ, ГТФ, ЦТФ, КФ.
3. Використання енергії. Незалежно від умов існування організму можна виділити 3 напрямки, за котрими відбувається використання енергії макроергічних сполук:
- процеси самовідновлення; ККД цих процесів складає 25-35% (без врахування ККД синтезу АТФ, котрий складає близько 50%), решта енергії макроергів перетворюється на вторинне тепло й виділяється з організму.
- робота механізмів активного транспорту проти градієнтів концентрацій – натрій-калієва помпа зовнішньої клітинної мембрани, кальцієва помпа СПР, всмоктування в кишківнику, реабсорбція та секреція в ниркових канальцях. ККД – близько 20%.
- механічна робота скелетних та гладких м’язів.
Отже, за відсутності виконання зовнішньої роботи, вся ернергія, що використовується організмом, перетворюється на тепло і виділяється з організму. Процеси біосинтезу речовин спряжені з процесами їх розпаду, котрі йдуть з вивільненням енергії у вигляді тепла; йонні помпи створюють градієнти концентрації, за якими надалі йони рухаються пасивно, що супроводжується виділенням енергії у вигляді тепла; робота серця йде на подолання опору судин Ù виділення енергії у вигляді тепла.
Тому, виділення тепла з організму проходить у вигляді тепла (первинного та вторинного).
Методи визначення енерговитрат організму:
1. Пряма калориметрія. Дослідження проводять за допомогою спеціальних пристроїв – калориметрів, які не допускають втрати тепла в зовнішнє середовище (а саме в цьому й полягає технічна складність методу). Прилад має подвійні стінки, між якими по системі посудин рухається рідина. Організм, який знаходиться в калориметрі, виділяє тепло Ù рідина в трубах нагрівається. Розрахунок енерговитрат проводять за формулою:
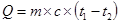 , де
, де
Q – тепловтрати організму;
m – маса рідини в трубах;
с – питома теплоємність рідини;
t1 – t2 – різниця температури рідини за час дослідження.
Оцінка енерговитрат за виділенням тепла із організму можлива, тому що вся енергія, яка використовується організмом, перетворюється в тепло і виділяється з організму у вигляді тепла (якщо не виконується зовнішня механічна робота).
2. Непряма калориметрія. Енерговитрати організму розраховують за його газообміном (за використанням кисню та виділенням вуглекислого газу). Правильність такого підходу є доведеною, тому що енергія поживних речовин звільняється в організмі людини, головним чином, в ході процесів аеробного окисного фосфорилювання; саме на ці процеси іде поглинений організмом О2, саме в ході цих процесів утворюється СО2, який виділяється з організму).
Визначення енерговитрат організму методом непрямої калориметрії включає наступні етапи:
а) визначення поглинання О2 та виділення СО2 організмом за певний час. Частіше всього розрахунки проводять, виходячи із різниці складу атмосферного (вдихуваного) та видихуваного повітря (у %) та величини ХОД. Для цього необхідно зібрати видихуване повітря в замкнуту ємність і визначити його газовий склад; визначають також ХОД;
б) розрахунок дихального коефіцієнту (ДК):
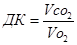 , де
, де
Vо2 – об’єм О2, що був поглинений організмом за певний час;
Vсо2 – об’єм СО2, що був виділений організмом за той самий час.
Величина ДК в звичайних умовах змінюється від 0, 7 до 1, 0 і залежить від виду поживних речовин, які окиснюються в організмі. При окисненні вуглеводів ДК = 1, 0; білків – 0, 8; жирів – 0, 7. при змішаному окисненні поживних речовин ДК частіше всього коливається в межах від 0, 8 до 0, 85.
в) визначення за таблицями калоричного коефіцієнту кисню (ККО2). Його визначають виходячи із величини ДК. ККО2 вказує, яка кількість енергії вивільняється в організмі при вживанні ним 1л О2 при даному ДК. Таким чином, розмірність ККО2 – ккал/л О2.
г) розрахунок енерговитрат організму за певний час проводять, виходячи із:
- об’єму кисню, який організм використав за цей час (Vо2);
- ККО2.
Розрахунки проводять за формулою:
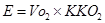 .
.
Енергетична цінність різних поживних речовин різна; в розрахунку на 1г речовини вона складає:
- жири = 9, 3 ккал (39кДж);
- білки = 4, 1 ккал (17кДж);
- вуглеводи = 4, 1 ккал (17кДж).
Тобто, енергетична цінність жирів більше, ніж в 2 рази перевищує енергетичну цінність вуглеводів і білків.
На окиснення 1г жиру використовується більше, ніж в 2 рази більше О2, ніж на окиснення 1г вуглеводів. Тому величина ККО2 змінюється при окисненні різних речовин на незначну кількість (від 4, 69 ккал/л при ДК = 0, 7 до 5, 05 ккал/л при ДК = 1, 0). Тому, при визначенні енерговитрат методом непрямої калориметрії нерідко обмежуються визначенням поглинанням О2 (технічно це набагато простіше, ніж визначення виділення СО2; поглинання О2 можна визначити, наприклад, по спірограмі) і середнього по величині ДК (0, 82 – 0, 85).
Необхідно пам’ятати, що ДК не завжди залежить від виду окиснених в організмі речовин:
- він підвищується (може бути більшим від 1, 0) при довільній гіпервентиляції Ù із організму виділяється СО2 крові;
- ДК стає більшим за 1, 0 безпосередньо після фізичного навантаження, внаслідок того, що із м’язів в кров виділяються недоокиснені продукти метаболізму і витісняють СО2 із бікарбонатів; зате пізніше ДК різко знижується і може стати меншим 0, 7 (0, 6 – 0, 5) внаслідок відновлення лужного резерву крові (бікарбонатів).
16. Основний обмін і умови його визначення, фактори, що впливають на його величину.
Основний обмін (ОО) – добові енерговитрати організму в стандартних умовах:
- зранку (тому, що є добові коливання рівня енерговитрат – він мінімальний вночі о 3-4 годині й максимальний ввечері о 17-18 годині);
- в умовах фізичного та емоційного спокою (м’язева робота супроводжується збільшенням енерговитрат організму, так як на скорочення м’язів необхідно витрачати значну кількість енергії; в умовах емоційної напруги активується симпатичний відділ вегетативної нервової системи Ù збільшується кількість катехоламінів та тироксину Ù розщеплення окиснення та фосфорилювання Ù збільшення енерговитрат організму);
- лежачи (щоб не витрачалася зайва енергія на скорочення м’язів на підтримання антигравітаційної пози);
- при температурі комфорту (при цьому підтримання сталості температури тіла не потребує напруження процесів тепловіддачі та теплопродукції, тобто на ці процеси не витрачається енергія);
- натще (через 10-12 годин після прийому їжі, щоб не проявлялася специфічно-динамічна дія їдла).
Специфічно-динамічна дія їжі – збільшення енерговитрат, що пов’язане з прийомом їжі. Після прийому вуглеводної та жирової їжі, специфічно-динамічна дія їжі складає 10-15%, а білкової – 30%. Збільшення енерговитрат пов’язане з активацією гладеньких м’язів ШКТ та виділення секретів (травних секретів), з процесами всмоктування – всі ці процеси протікають із використанням енергії АТФ. Амінокисноти після всмоктування в печінці дезамінуються та перамінуються, що також потребує енерговитрат, саме тому специфічно-динамічна дія білкової їжі вища, ніж вуглеводневої та жирової.
Відповідно, визначаючи ОО створюють умови, під час яких енергія окиснення поживних речовин витрачаєть на підтримання нормальної життєдіяльності організму в стані бадьорості, але за умови, що енерговитрати організму мінімальні. Енергія окиснення поживних речовин при цьому витрачається так:
- 50% її перетворюється на первинне тепло й виділяється з організму, 50% йде на синтез АТФ;
Витрати АТФ такі:
- процеси біосинтезу – 23%;
- скорочення м’язів (підтримання тонусу скелетних м’язів, скорочення міокарду та дихальних м’язів)– 15%;
- робота механізмів активного транспорту речовин – 12%.
Фактори від яких залежить величина ОО:
1. Стать.
<|
|
