
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Получение солей диазония
|
|
Наиболее часто для получения солей диазония используют реакцию диазотирования – взаимодействие первичных ароматических аминов с азотистой кислотой или нитритом натрия в присутствии минеральной кислоты:
Ar-NH2 + NaNO2 + 2 HX → ArN2+X- + NaX + H2O
Диазотирование проводят действием на водный раствор соли амина азотистой кислоты, при этом используют более двух молей минеральной кислоты на один моль амина. Избыток кислоты служит для стабилизации соли диазония. Так как соли диазония разлагаются при нагревании, а диазотирование является экзотермической реакцией, процесс проводят при охлаждении, поддерживая температуру не выше 5°С.
В реакцию диазотирования вступает амин, находящийся в виде основания, поэтому на скорость реакции оказывает влияние как концентрация протонов в растворе, так и основность используемого амина. Электронодонорные заместители стабилизируют катион анилиния, т.e. способствуют делокализации положительного заряда и увеличивают основность амина. Электроноакцепторные уменьшают электронную плотность бензольного кольца, усиливая положительный заряд иона анилиния, что приводит к дестабилизации по сравнению с амином и уменьшению основности. Таким образом, заместители, увеличивающие основность, активируют ароматический амин по отношению к реакции диазотирования.
Азотистая кислота, образующаяся при взаимодействии нитрита натрия с минеральной кислотой, в кислой среде может образовывать несколько диазотирующих частиц. На природу диазотирующей частицы влияет среда:


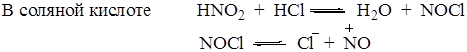
Все диазотирующие агенты могут быть представлены как производные азотистой кислоты NO-X.
Механизм реакции диазотирования может быть представлен как процесс, в котором амин выступает в качестве нуклеофила, передавая свою неподеленную пару электронов электрофильной частице:
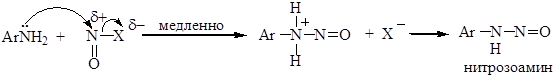
Образующийся нитрозамин в кислой среде превращается в соль диазония:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение

При взаимодействии со щелочью соли диазония переходят в диазогидраты:
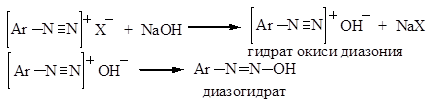
Диазогидраты в водных растворах устойчивы и образуют диазотаты:

Таким образом, диазогидраты в зависимости от кислотности среды могут образовывать соли диазония или диазотаты, т.е. проявляют амфотерные свойства.
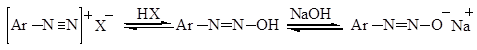
Б.А. Порай-Кошиц установил, что это равновесие можно смещать изменением рН среды.
|
|
