
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
равновесия
|
|
Вычислите Δ Н 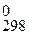 , Δ G
, Δ G 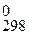 (табл.П.1.7) и К С для реакции
(табл.П.1.7) и К С для реакции
NН3 (г) + Н2О (ж) 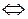 NН
NН 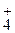 (р) + ОН
(р) + ОН 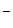 (р). (4.38)
(р). (4.38)
Определите: 1) в каком направлении сильнее смещено равнове-сие реакции (4.38)при стандартных условиях; 2) в каком направлении смещается равновесие при нагревании.
Подтвердите расчеты экспериментально. Для этого в пробирку налейте 2-3 мл раствора аммиака и добавьте 1-2 капли раствора фенолфталеина. О чем свидетельствует малиновое окрашивание раствора? Нагрейте раствор над спиртовкой. По какой причине раствор обесцвечивается?
Напишите выражение для константы равновесия и объясните наблюдаемые явления.
Опыт 4.2.4. Термическая устойчивость карбонатов
В пробирку с газоотводной трубкой засыпьте порошкообразный карбонат (по вариантам) слоем толщиной 1 см (табл. 4.2).
Т а б л и ц а 4.2
| Вариант | ||||
| Карбонат | СаСОз | MgCO3 | ВаСО3 | СuСО3 |
Газоотводную трубку опустите в стакан с раствором Са(ОН)2. Пробирку нагрейте. Определите время начала выделения СО2. Составьте уравнение реакции термического распада карбоната и рассчитайте Δ Н 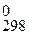 , Δ G
, Δ G 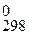 , Δ S
, Δ S 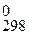 (табл.П.1.7) этого процесса.
(табл.П.1.7) этого процесса.
Какова температура начала термического распада карбоната при Δ G 0 = 0?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие реакции называют гомогенными, какие гетерогенными?
2. От каких факторов зависит скорость химической реакции?
3. Как формулируется закон действующих масс? К каким системам он применим?
4. Чем отличается запись кинетического уравнения для гомогенных реакций от гетерогенных?
5. Напишите кинетические уравнения для следующих химических реакций, протекающих в гомогенной системе:
а) СО (г) + С12 (г) → СОС12 (г);
б) 2NO (г) + О2 (г) → 2NO2 (г);
в) 4НС1 (г) + О2 (г) → 2Н2О (г) + 2С12 (г).
6. Напишите кинетические уравнения для следующих химических реакций, протекающих в гетерогенной системе:
а) С (к) + О2 (г) → СО2 (г);
б) СО2 (г) + С (к) → 2СО (г);
в) СаО (к) + СО2 (г) → СаСО3 (к).
7. Какой физический смысл константы скорости химической реакции? От каких факторов она зависит?
8. Чем объясняется увеличение скорости реакции с ростом температуры?
9. Что называется энергией активации?
10. Каким правилом определяется зависимость скорости реакции от температуры?
11. Что показывает температурный коэффициент скорости хи-мической реакции?
12. Какая зависимость между скоростью реакции и временем еепротекания?
13. Перечислите факторы, от которых зависит: а) скорость реакции; б) константа скорости реакции.
14. Что такое кинетическое уравнение реакции?
15. Что такое энергия активации реакции?
16. Объясните, почему скорости реакций меняются в очень широких пределах, а их температурные коэффициенты почти постоянны.
17. Какое утверждение представляется вам более правдопо-добным: а) чем больше тепловой эффект реакции, тем больше ее энергия активации; б) чем прочнее связи в реагирующих молекулах, тем больше энергия активации реакции между ними; в) чем медленнее реакция, тем выше ее энергия активации?
18. Механизм некоторой реакции включает три стадии. Опре-делены самая быстрая и самая медленная стадия. Как соотносятся между собой энергии активации этих трех стадий?
19. Что такое катализ?
20. Почему катализатор увеличивает скорость реакции?
21. Как вы считаете, почему подавляющее большинство биохимических каталитических процессов являются гомогенными, а технических – гетерогенными?
22. Определите единицу измерения константы скорости реак-ции, для которой V = k · с 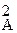 · с B.
· с B.
23. Для какой из двух реакций выше вероятностный фактор Рор
а) 2Н2 (г) + О2 (г) = 2Н2О (г);
б) 2СО (г) + О2 (г) = 2СО2 (г)?
24. Какой минимум экспериментальных данных необходим для расчета энергии активации реакции?
25. Как различаются энергии активации прямой и обратной реакций? Должны ли они различаться по знаку?
26. Может ли температурный коэффициент скорости хими-ческой реакции быть отрицательным?
27. Могут ли быть равны друг другу температурные коэф-фициенты скорости прямой и обратной реакций?
|
|