
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическая часть. Скоростью реакции называется количество вещества, изменяющееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз
|
|
Скоростью реакции называется количество вещества, изменяющееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени.
Различают среднюю и мгновенную скорости реакции. Средняя скорость реакции равна
υ ср = (с2 – с1)/(τ 2 – τ 1) = - Δ с/Δ τ (1)
где с 2 и с 1 - концентрации исходного вещества в момент времени τ 2 и τ 1. Знак минус означает, что концентрация исходного вещества уменьшается. Если определять скорость реакции по увеличению концентрации образующихся продуктов реакции, то перед дробью будет стоять знак плюс, поэтому в общем случае:
υ ср = ± (с2 – с1)/(τ 2 – τ 1) = ± Δ с/Δ τ (2)
Скорость реакции в данный момент времени или мгновенная (истинная) скорость реакции равна: υ = ± dc/dτ (3)
Скорость реакции в системе СИ имеет единицу измерения [моль× м-3× с-1], однако также используются и другие единицы измерения [моль× л-1× с-1], [моль× см-3× с-1], [моль× см-3× мин-1].
Скорость реакции зависит от концентрации реагирующих веществ. Эта зависимость выражается законом действующих масс или основным кинетическим уравнением: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях некоторых чисел, определяемых экспериментальным путем.
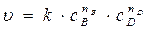 Например, скорость необратимой реакции b B + d D → l L + m M равна:
Например, скорость необратимой реакции b B + d D → l L + m M равна:
(4),
где k – константа скорости реакции; nB и nD – коэффициенты, называемые порядками реакции по веществам В и D, которые могут быть любыми небольшими числами (целыми или дробными, или, в особых условиях, равными нулю). Для элементарных реакций (реакций идущих в одну стадию) порядки реакции по веществам совпадают со стехиометрическими коэффициентами.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Константа скорости реакции k не зависит от концентрации реагентов, но зависит от их природы и температуры. Из уравнения (4) следует, что при с D = c B = 1 моль/л, константа скорости реакции численно равна скорости реакции u = k. Из этого же уравнения видно, что размерность константы скорости реакции зависит от порядка реакции, поскольку размерность скорости реакции для всех гомогенных реакций одинакова.
Сумма порядков реакции по реагентам называется общим порядком реакции n: n= å ni,
где ni - порядок реакции по i -реагенту.
Теоретически предсказать порядок реакции трудно, его определяют экспериментально. Порядок реакции зависит от ее сложности.
Например, реакция образования иодида водорода H2 + I2 (г) = 2HI (г)
протекает в одну стадию, следовательно, u = kc H2 cI2 т.е. n Н2 = 1 и n I2 = 1 и n = 1+1=2.
Однако в большинстве случаев реакции многостадийны. Наиболее часто встречаются реакции первого, второго, иногда – третьего порядков. Реакции более высокого порядка, чем третий, неизвестны.
Итак, порядок простой (одностадийной) реакции равен сумме стехиометрических коэффициентов, а сложной (многостадийной) реакции ниже этой суммы.
Скорость реакции первого порядка характеризуется кинетическим уравнением
u = kc = - d c /d τ
Решение данного уравнения для начального условия сτ =0 = с0 приводит к выражению:
c = с0 е-kτ или k =(1/ τ)∙ ln(c 0 /c)(5)
Константа скорости реакции первого порядка имеет единицу измерения обратного времени: [ с- 1].
Подставляя уравнение (5) в (4), найдем, что скорость реакции равна:
υ = k с0 е-kτ (6)
Как видно, концентрация реагентов и скорость реакции первого порядка уменьшаются во времени по экспоненциальному закону.
Уравнение (5) можно записать в виде:
ln (c 0 /c) = kτ или ln c = ln c 0 -kτ (7)
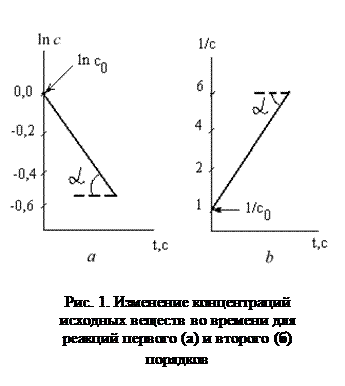
Из графика изменения концентрации реагента во времени (рис.2а) легко определить константу скорости реакции:
tga = k = Dln c /D τ.
 В качестве критерия скорости реакции нередко используется период полупревращения τ 1/2, равный времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией, т.е. с 0, 5 = с0 /2. Подставляя с = с 0, 5 = с0 /2 и τ = τ 0, 5 в уравнение (5) и, преобразуя его, получаем: τ 1/2 = ln2/ k = 0, 693/ k (8)
В качестве критерия скорости реакции нередко используется период полупревращения τ 1/2, равный времени, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией, т.е. с 0, 5 = с0 /2. Подставляя с = с 0, 5 = с0 /2 и τ = τ 0, 5 в уравнение (5) и, преобразуя его, получаем: τ 1/2 = ln2/ k = 0, 693/ k (8)
Как видно, период полупревращения реагента для реакции первого порядка не зависит от начальной концентрации.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Скорость реакции второго порядка для двух реагентов В и D подчиняется кинетическому уравнению: u u =kc B c D (9)
Если c B = c D или если реагируют одинаковые частицы, то u = kc 2 (10)
Используя уравнение (3) и разделяя переменные, получаем
d c / c 2 = - k d τ
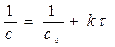 Решая уравнение для начального условия с τ = 0 = с 0, получим:
Решая уравнение для начального условия с τ = 0 = с 0, получим:
(11)
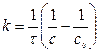
или (12)
Единица измерения k [моль-1× л× с-1].
Кинетическую кривую удобно представить в координатах 1/ с-τ (рис.2б).
Величина, обратная концентрации, растет во времени линейно.
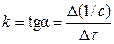 Константу скорости реакции можно определить графически по экспериментальной кривой (рис.2, б):
Константу скорости реакции можно определить графически по экспериментальной кривой (рис.2, б):
Период полупревращения для реакций второго порядка уменьшается с ростом концентрации реагента:
τ 1/2 = 1/ с0∙ k (13)
Таким образом, характер изменения концентрации реагента во времени, время полупревращения и единица измерения константы скорости зависят от порядка реакции.
Уравнение кинетической кривой позволяет решать целый ряд задач: определение концентрации в любой момент времени, расчет времени, необходимого для достижения заданной концентрации, вычисление константы скорости по экспериментальным данным и некоторые другие.
|
|
