
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Основные понятия и терминология раздела
|
|
Химические реакции разделяются на гомогенные и гетерогенные.
Гомогенные реакции характеризуются отсутствием поверхности раздела между реагентами, поэтому их взаимодействие протекает по всему объему системы.
При гомогенных реакциях реагирующие вещества находятся в одном агрегатном состоянии. Например:
а) реакции между газообразными веществами
2NO + О2 → 2NО2
б) реакции в растворах
H2SО4 + 2КОН → K2SО4 + 2Н2О
Гетерогенные реакции характеризуются наличием поверхности раздела между реагентами, где и протекает их взаимодействие.
При гетерогенных реакциях реагирующие вещества находятся в разных агрегатных состояниях. Например:
СаО(т) + СО2(г) → СаСО3(т)
Одним из основных параметров химических реакций являйся скорость, с которой они протекают.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени
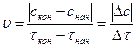
Если измерять концентрации веществ в молях на литр, а время - в секундах, то единицей измерения скорости реакции будет моль/(л · с).
Так как в реакции могут принимать участие в качестве реагентов и продуктов несколько соединений, следует говорить не о скорости химического процесса вообще, а о скорости реакции по какому-либо одному компоненту (Xi). Кинетическая кривая, отражающая изменение концентрации какого-либо вещества во времени c(Xi) = f(τ) в ходе химической реакции, имеет разный вид для реагента и продукта реакции (рис. 5.1). Кинетическая кривая дает информацию об истинной (мгновенной) скорости реакции в каждый момент времени. Истинная скорость реакции в данный момент времени (τ нач, τ кон) определяется на графике как тангенс угла наклона соответствующей касательной (1, 2) к оси времени.
Истинная скорость химической реакции характеризует скорость в данный момент времени (Δ τ → 0)

Как видно из рис. 5.1, касательные 1 и 2 характеризуются разными углами наклона α 1 и α 2, что свидетельствует об изменении скорости химической реакции по мере ее протекания. Поэтому наряду с истинной скоростью для характеристики химического процесса используют также среднюю скорость.
Средняя скорость химической реакции по данному компоненту является усредненной скоростью за данный промежуток времени
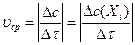
|
|
