
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Количественные характеристики гидролиза.
|
|
Равновесное состояние гидролиза характеризуется постоянной величиной (при определенной температуре), называемой константой гидролиза Kг.
Поскольку при гидролизе имеет место конкуренция между двумя противоположными процессами, Kг зависит от константы диссоциации Kдисс. слабого электролита (Kосн или Kк-ты) и ионного произведения воды Kв.
Для случая гидролиза по катиону (NH4+):
NH4+ + HOH ⇄ NH4OH + H+
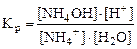
Так как [H2O] = const, то Kp∙ [H2O] = const и обозначается Kг –это константа гидролиза.
Тогда 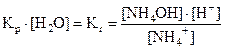
Умножив числитель и знаменатель на [OH–], получим
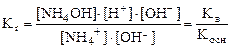 , т.к. [H+]∙ [OH-]=Kв, а
, т.к. [H+]∙ [OH-]=Kв, а 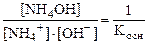 .
.
Аналогично для гидролиза по аниону  .
.
Для гидролиза по катиону и аниону одновременно: 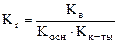 .
.
Для ступенчатой формы гидролиза константа имеет определенные значения для каждой ступени. В формуле учитывается константа диссоциации слабого компонента для соответствующей ступени диссоциации.
Для расчета Кг соли, разлагающейся с выделением осадка, константа диссоциации соответствующего вещества Кд должна быть заменена его произведением растворимости ПР.
Пользуясь выражениями констант гидролиза, можно выразить формулы для расчета рН в растворах гидролизованных солей. Для солей, образованных слабым основанием можно записать:
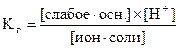 .
.
Если соль сильный электролит, то [ион соли] = Cсоли.
Тогда 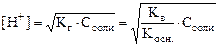 .
.
Тогда 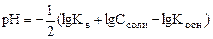 .
.
Принимая Kв = 10-14 и учитывая pH = -lg[H+]; pKд = -lgKд.
Для солей, гидролизующихся по катиону имеем:
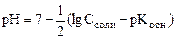
Для солей, образованных слабой кислотой и гидролизующихся по аниону, проводя аналогичные преобразования получим:
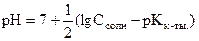 .
.
При гидролизе солей третьего типа (по катиону и аниону) pH зависит только от величин констант диссоциации образующихся слабого основания и слабой кислоты.
Так как 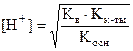 , то
, то 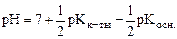 .
.
Интенсивность протекания гидролиза характеризуется степенью гидролиза hгидр - отношением числа гидролизованных молекул к общему числу растворённых молекул (выражается в процентах):
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
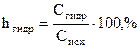
|
|
