
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
III. Теории химической кинетики
|
|
Одной из задач кинетики является теоретический расчет скорости реакции в заданных условиях (без проведения соответствующих экспериментов), зная только концентрации и свойства исходных веществ (и продуктов реакции). Для этого необходимо уметь рассчитывать константу скорости реакции при заданной температуре, следовательно, уметь вычислять значения А и Е в уравнении Аррениуса.
Теория активных столкновений молекул позволяет рассчитывать значения предэкспоненциального множителя А, а теория активного комплекса (или теория переходного состояния) - и значения Е, т. е. позволяет вычислять значение константы скорости при данной температуре.
Теория активных столкновений (ТАС)
Основные положения теории активных (молекулярных) столкновений:
1. Любая химическая реакция протекает через промежуточную стадию образования активных молекул реагирующих веществ (только из активных молекул могут образоваться продукты реакции). Активные молекулы всегда находятся в равновесии с неактивными (нормальными) молекулами.
2. Реакция образования активных молекул эндотермична и идет с поглощением теплоты E ΄ в расчете на 1 моль активных молекул. Схематично можно записать:
А норм. 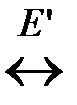 А *акт.
А *акт. 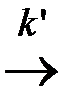 продукты
продукты
На первой стадии устанавливается равновесие меду активными и нормальными молекулами реагирующих веществ, на второй стадии из активных молекул образуются продукты реакции (константа скорости k ΄).
4. Константа скорости k ΄ не зависит от температуры, т. е. скорость реакции при повышении температуры увеличивается только за счет увеличения концентрации активных молекул.
5. Активные молекулы отличаются от неактивных только тем, что имеют некоторую избыточную энергию по сравнению со средней энергией молекул. Молекулы приобретают избыточную энергию путем соударения молекул и взаимного перераспределения энергии при этом.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Химическая реакция начинается со столкновения двух частиц. Однако, как показывают опыты, число прореагировавших частиц (молекул, ионов) при не очень высоких температурах на много порядков ниже числа сталкивающихся частиц. Так, например, в реакции:
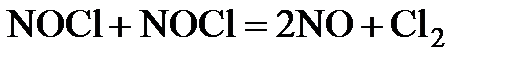
при 529 К и 1 атм образуется примерно 2·10-6 моль NO в 1 см3 за 1 с. Расчет полного числа столкновений при этих условиях приводит к значениям порядка 105 молей NO/(см3·с). Если обозначить через z число общих столкновений, а символом za – число активных столкновений, приводящих к реакции, то для указанной реакции
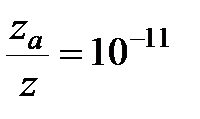 ,
,
т. е. активным столкновением будет только одно из 1011 общих столкновений.
Именно расхождения между значениями z и za привели Аррениуса к идее о том, что в реакцию могут вступать только молекулы, обладающие определенным избытком энергии (энергией активации). Теория активных столкновений приводит к следующему соотношению между za и z:
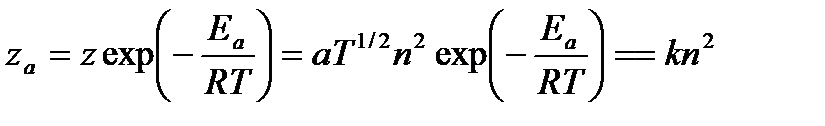
в котором учтена зависимость z от температуры Т (z = аT 1/2 n 2). Величина n- число молекул в см3; Ea – так называемая “ классическая” энергия активации, равная разности между потенциальными энергиями активных и исходных молекул; а – константа, зависящая от размеров вступающих в реакцию молекул.
Выражение для константы скорости:
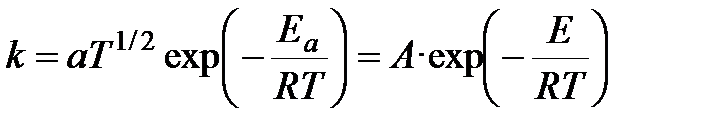 .
.
Теория активных соударений позволила наметить путь теоретического расчета константы скорости реакции: предсказала правильный ход зависимости константы скорости от температуры, позволила рассчитать для ряда реакций константы скорости по известному значению энергии активации. Представления об энергетическом барьере и об «активных» молекулах хорошо объясняют ряд фактов.
1. Химическая реакция всегда протекает с несоизмеримо меньшей скоростью, чем это соответствует расчету с предположением результативности каждого соударения.
2. Для сходных реакций при одинаковых температурах и концентрациях число соударений приблизительно одинаково, а скорость может отличаться в десятки тысяч раз.
3. Число соударений с изменением температуры на 10 град изменяется на 2-3%, однако скорость реакции изменяется в 2-4 раза.
Недостатки:
· Не может быть объяснена резкая температурная зависимость скорости реакции, вследствии того, что величина Z слабо изменяется с изменением температуры 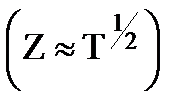 .
.
· Не позволяет рассчитывать значение энергии активации исходя из параметров молекул реагирующих веществ.
ТЕОРИЯ АКТИВНОГО КОМПЛЕКСА (ТАК)
Более совершенной является теория переходного состояния, в которой в качестве условия возможности протекания реакции рассматривается не столкновение двух молекул, а образование ими непрочного промежуточного комплекса, что позволяет сразу учесть необходимость определенной ориентации реагирующих молекул. Энергия системы зависит от взаимного расположения (конфигурации) атомов и сил взаимодействия между ними. Сама химическая реакция рассматривается как переход от начальной конфигурации атомов (исходные вещества) к конечной (продукты реакции) при непрерывном изменении соответствующих координат (межатомных расстояний, валентных углов). В ходе этого процесса непрерывно изменяется энергия всей системы, при этом всегда образуется некоторая промежуточная конфигурация атомов, соответствующая максимуму потенциальной энергии системы, - эту конфигурацию и называют активным (промежуточным) комплексом. Активный комплекс не является, в отличие от обычной молекулы, устойчивой частицей, так как соответствует максимуму, а не минимуму потенциальной энергии.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Рассмотрим с позиций теории переходного комплекса реакцию между молекулой АВ и атомом С:
АВ + С Û [ А... В... С ]¹ ® А + ВС.
Данную реакцию формально можно представить в виде двух последовательных стадий: разрыва связи А - В и образования связи В - С. В действительности эти стадии не происходят по отдельности: атом С при сближении с молекулой АВ начинает взаимодействовать с атомом В, в результате связь А - В слабеет (расстояние между атомами А и В увеличивается), при дальнейшем усилении связи В - С связь А - В все более слабеет до тех пор, пока не образуется молекула ВС (атомы А и В находятся на таком расстоянии, что практически не взаимодействуют друг с другом).
Изменение энергии системы при переходе от исходных к конечным веществам представлено на рис. Энергия переходного комплекса выше энергии исходных веществ на величину Δ Е 0, которая представляет собой энергию активации реакции.
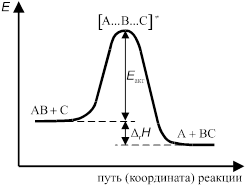
Рис. Изменение потенциальной энергии вдоль координаты реакции.
Согласно теории переходного комплекса между исходными веществами и комплексом устанавливается равновесие. Константа этого равновесия равна
 ,
,
где 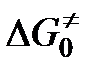 ,
, 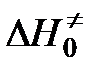 и
и 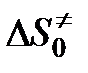 — свободная энергия, энтальпия и энтропия образования переходного комплекса из исходных веществ,
— свободная энергия, энтальпия и энтропия образования переходного комплекса из исходных веществ,
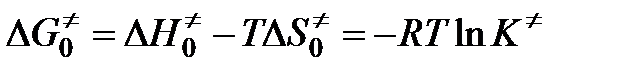 .
.
Скорость образования конечного продукта ВС можно выразить двояким образом. Во-первых, как скорость бимолекулярной реакции
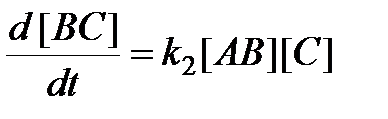 .
.
Во-вторых, как скорость разложения переходного комплекса:
 ,
,
где c¹ — константа скорости распада переходного комплекса. Тогда
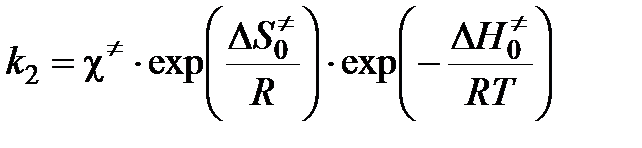 .
.
Чтобы получить окончательное выражение для константы скорости бимолекулярной реакции, необходимо знать константу скорости распада переходного комплекса. Полагают, что эта константа равна частоте колебаний разрывающейся “критической” связи в комплексе (в данном случае связи А - В). Подробная теория переходного состояния дает для этой частоты величину kT / h, где k — константа Больцмана, h — постоянная Планка. Тогда
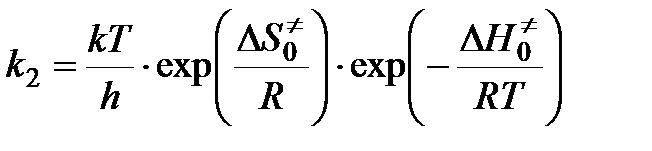 ,
,
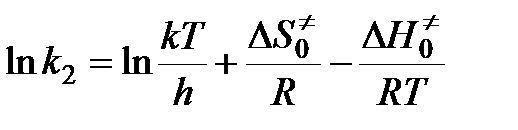 .
.
С другой стороны, по уравнению Аррениуса
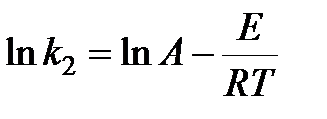 .
.
Тогда
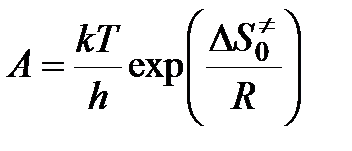 ,
, 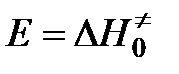 .
.
Значение этого уравнения состоит в том, что оно объясняет причины существования низких величин предэкспоненциального множителя, для учета которых в теории активных столкновений молекул вводится стерический фактор Р
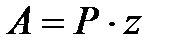 .
.
Величина А зависит от энтропии образования переходного комплекса. В рассматриваемом случае образование одной частицы активного комплекса из двух частиц (молекулы АВ и атома С) должно сопровождаться уменьшением энтропии, т. е.
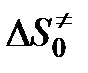 < 0,
< 0, 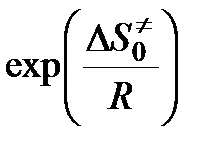 < 1.
< 1.
Так, например, если 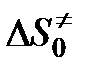 = -25 Дж/(моль·К), то
= -25 Дж/(моль·К), то
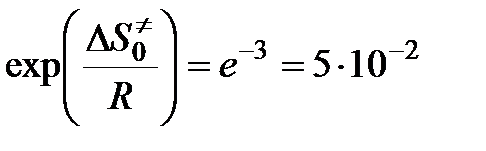 ,
,
что делает понятным появление малых стерических множителей в теории активных столкновений.
Энергия активации в теории переходного состояния заменяется изменением энтальпии 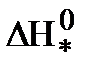 , а энтропийный сомножитель
, а энтропийный сомножитель 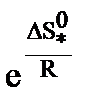 - энтропия активации, тесно связана со строением исходных молекул и активного комплекса. Например, разрушение сложных молекул и образование более простого активного комплекса ведет к росту “беспорядка” в системе и сопровождается повышением энтропии.
- энтропия активации, тесно связана со строением исходных молекул и активного комплекса. Например, разрушение сложных молекул и образование более простого активного комплекса ведет к росту “беспорядка” в системе и сопровождается повышением энтропии.
Зависимость скорости реакции не только от энергии активации, но и от энтропии активации, позволяет объяснить существование медленных реакций, имеющих малую энергию активации, быстрых реакций с большой энергией активации, различие скоростей реакции с одинаковыми энергиями активации.
Теория активного комплекса применима к реакциям, протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции, протекающие в газовой фазе. Дело в том, что молекулы реагентов в жидкости находятся на более близком расстоянии, когда силы взаимодействия между ними нельзя считать малыми или даже отсутствующими, что часто допустимо в газах.
|
|
