
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В т. э.: в растворе соль CH3COONa
|
|
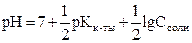 ! pH > 7
! pH > 7
После т. э.: в растворе соль CH3COONa и избыток NaOH (который подавляет гидролиз соли и определяет значение рН):
pH = 14 + lg[ОH–]изб = 14 + lgСизб(NaOH)
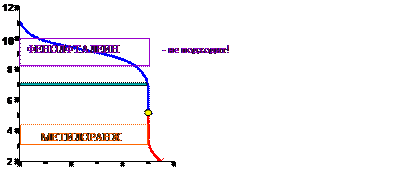
Прогнозирование возможности титрования
Условие наличия скачка на кривой титрования:
Кд > 10-7 – 10-8 (pK < 7-8)
Общий вид кривой титрования слабой кислоты сильным основанием

Титрование слабого основания сильной киcлотой
NH4OH + HCl = NH4Cl + H2O
До начала титрования: в растворе слабое основание NH4OH
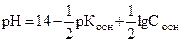
До т. э.: в растворе смесь NH4OH и NH4Cl (буферная)
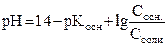
В т. э.: в растворе соль NH4Cl
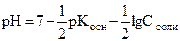 ! рН < 7
! рН < 7
После т. э.: в растворе соль NH4Cl и избыток HCl (который подавляет гидролиз соли и определяет значение рН):
pH = –lg[H+]изб = –lgCизб(HCl)
Общий вид кривой титрования слабого основания сильной кислотой
Титрование соли, образованной слабой кислотой и сильным основанием
KCN + HCl = HCN + KCl
из щелочной среды в кислую
|
|
