
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение гидролиза
|
|
Однако и в этом случае гидролиз протекает в малой степени только по первой стадии. По последующим стадиям он будет идти крайне незначительно и им можно пренебречь.
4. Соли, образованные слабой кислотой и слабым основанием:
СН3СООН + NН4OН = СН3СООNН4 + Н2О
2 Al(OH)3 + 3 H2СO3 = Al2(СO3)3 + 6 Н2О
Такие соли лучше всего подвергаются гидролизу, так как в этом случае с Н2О взаимодействуют и катионы основания, и анионы кислоты:
СН3СООNН4 → СН3СОО‾ + NН4+
СН3СОО‾ + НОН 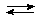 СН3СООН + ОН‾
СН3СООН + ОН‾
NН4+ + НОН 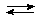 NН4ОН + Н+
NН4ОН + Н+
Причем в растворе одновременно образуются и ионы Н+ и ионы ОН‾ . Среда в растворе такой соли может быть кислой, нейтральной или щелочной.
Если кислота и основание, образующие соль, являются слабыми электролитами примерно одинаковой cилы, то катионы основания и анионы кислоты будут в одной и той же мере взаимодействовать с молекулами Н2О. Число ионов Н+ и ОН¯ в растворе будет примерно равным. Они вступят в реакцию между собой
(Н+ + ОН¯ = Н2О) и среда в растворе такой соли останется нейтральной.
Если же какой-то из электролитов (кислота или основание) будет слабее по сравнению с другим, то среда в растворе такой соли будет кислой или щелочной. Так, если кислота, образующая соль, является более слабым электролитом, чем основание, то анионы кислоты будут в большей степени взаимодействовать с Н2О, чем катионы основания. В результате этого ионов ОН¯ в растворе станет накапливаться больше, чем ионов Н+ и среда в нем будет щелочной. Если же основание, образующее соль, слабее, чем кислота, то среда в растворе такой соли, наоборот, будет кислой.
Соли, образованные и слабой кислотой, и слабым основанием, подвергаются гидролизу в гораздо большей степени, чем все остальные, т.к. образующие ионы Н+ и ОН¯ связываются в Н2О и равновесие в реакции гидролиза смещается в правую сторону.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В этом случае гидролиз часто протекает до конца не только по первой стадии, но и в значительной степени по последующим стадиям.
Для целого же ряда таких солей гидролиз является необратимым и приводит к полному разложению такой соли на соответствующую кислоту и основание:
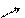 СО2
СО2
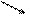 Al2(СO3)3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2СO3
Al2(СO3)3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2СO3
Н2О
Al2 S3 + 6 Н2О = 2 Al(OH)3↓ + 3 H2 S↑
Такие соли в водных растворах вследствие этого существовать не могут. В таблицах растворимости в клеточках, соответствующим данным солям, часто ставится прочерк.
Количественно гидролиз характеризуется безразмерной величиной h, называемой степенью гидролиза. Она показывает, какая часть из находящихся в растворе ионов электролита (катионов или анионов) подвергается гидролизу, т.е. взаимодействует с Н2О.
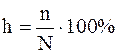
где N – общее число ионов слабого электролита в растворе;
n – число ионов слабого электролита подвергнувшихся гидролизу.
Степень гидролиза тем больше, чем слабее основание или кислота, образующие соль. Она увеличивается также при разбавлении растворов и при их нагревании.
С увеличением температуры ионное произведение Н2О значительно возрастает, а значит, увеличиваются и концентрации ионов Н+ и ОН¯. Ионы слабого электролита сильнее взаимодействуют с ними. В результате в кипящей воде полному гидролизу могут подвергаться и соли, образованные только каким-то одним слабым электролитом.
Гидролиз соли является обратимой реакцией и подчиняется принципу Ле Шателье, поэтому изменяя концентрацию одного из реагирующих веществ или продуктов реакции, можно смещать равновесие в ту или иную сторону.
Гидролиз соли при разбавлении раствора увеличивается, так как возрастает концентрация исходного компонента (Н2О). Это смещает равновесие вправо, т.е. в сторону усиления гидролиза.
Руководствуясь принципом Ле Шателье, можно усиливать или подавлять гидролиз, добавляя в раствор и другие вещества.
Так, ослабить гидролиз можно введением в раствор одного из продуктов гидролиза:
а) сильной кислоты, если гидролиз соли идет по катиону;
б) щелочи, если гидролиз соли идет по аниону.
Например, железо(III)-нитрат Fe(NO3)3 гидролизуется по катиону, в результате чего в растворе накапливаются ионы Н+:
Fe3+ + Н2О 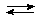 FeOH2+ + H+
FeOH2+ + H+
Поэтому ослабить гидролиз можно добавлением кислоты (например, HNO3) или добавлением другой соли, тоже гидролизующей по катиону (например, CuCl2). Это будет равносильно введению в раствор Fe(NO3)3 сильной кислоты (HCl):
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Cu2+ + Н2О 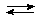 CuOH+ + H+
CuOH+ + H+
Для ослабления гидролиза соли Na2CO3, идущего по аниону
CO32– + Н2О 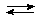 HCO3– + OH–
HCO3– + OH–
необходимо ввести в раствор щелочь (NaOH) или другую соль, тоже гидролизующуюся по аниону, например, Na2S
S2– + Н2О 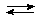 HS– + OH–
HS– + OH–
Аналогичным образом можно усиливать гидролиз солей, добавляя в раствор вещества, которые связывали бы его продукты. Например, если в ходе гидролиза накапливаются ионы Н+, то для его усиления нужно добавить в раствор щелочь.
|
|
