
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Анализ щелочной смеси неизвестного состава
|
|
| № п/п | Раствор | Соотноше-ние бъемов V1 (Ф.Ф.) и V2 (М.О.) | Равенства реакций | График титрования |
| NaHCO3 | V1 = 0 | ф.ф.: NaHCO3+HCl ¹ м.о.: NaHCO3 + HCl = H2CO3 + NaCl | 
| |
| NaOH | V1 = V2 | ф.ф. и м.о.: NaOH + HCl = NaCl + H2O | 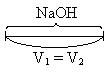
| |
| Na2CO3 | 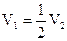
| ф.ф.: Na2CO3 + HCl = NaHCO3 + NaCl м.о.: Na2CO3 + 2HCl = H2CO3 + 2NaCl | 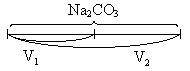
| |
| NaOH + + Na2CO3 | 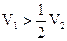
| ф.ф.: NaOH + HCl = NaCl + H2O Na2CO3 + HCl = NaHCO3 + NaCl м.о.: NaOH + HCl = NaCl + H2O Na2CO3 + 2HCl = H2CO3 + 2NaCl |

| |
| Na2CO3 + + NaHCO3 | 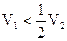
| ф.ф.: Na2CO3 + HCl = NaHCO3 + NaCl м.о.: Na2CO3 + 2HCl = H2CO3 + 2NaCl NaHCO3 + HCl = H2CO3 + NaCl | 
| |
| NaOH + + NaHCO3 | Смесь после растворения в воде не существует, так как произойдет реакция NaHCO3 + NaOH = Na2CO3 + H2O При эквивалентном соотношении в растворе будет присутствовать карбонат натрия Na2CO3 (3); при избытке NaOH в растворе будет каустическая сода NaOH + Na2CO3 (4); при избытке NaHCO3 в растворе будет кальцинированная сода Na2CO3 + NaHCO3 (5). |
Задача 1.
Навеска вещества 0, 3106 г, содержащего ионы Na+ и CO32-, растворена в воде. Раствор имеет щелочную реакцию. На титрование раствора в присутствии фенолфталеина расходуется 26, 20 мл, а в присутствии метилового оранжевого - 29, 30 мл раствора H2SO4.
T(H2SO4) = 0, 01200 г/мл.
Вычислить процентное содержание веществ, содержащихся в образце.
| Дано: m н = 0, 3106 г T(H2SO4) = 0, 01200 г/мл V ф.ф. (H2SO4) = 26, 20 мл |
V м.о. (H2SO4) = 29, 30 мл

|
| w =? |
Решение:
| NaHCO3 | V1 ¹ 0 | 
| |
| NaOH | V1 ¹ V2 | 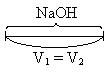
| |
| Na2CO3 | 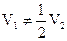
| 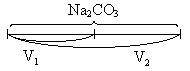
| |
| „ | NaOH + Na2CO3 | 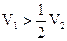
| 
|
 5 5
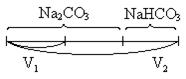
| Na2CO3 + NaHCO3 | 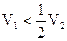
| 
|
Вывод: в растворе содержится каустическая сода NaOH + Na2CO3
| Ф.Ф. | 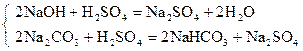
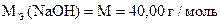
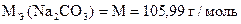
|
| М.О. | 
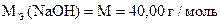
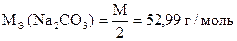
|
29, 30 - 26, 20 = 3, 10 мл - V H2SO4 эквивалентный 1/2 Na2CO3
3, 10 × 2 = 6, 20 мл - V H2SO4 эквивалентный Na2CO3
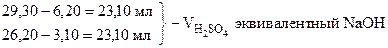
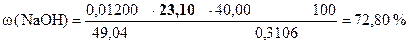
‚ ƒ „ …
| - | Сколько моль-экв H2SO4 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв H2SO4 содержится в 23, 10 мл раствора. Столько же моль-экв NaOH содержится в навеске. |
| ƒ - | Сколько г NaOH содержится в навеске. |
| „ - | Сколько г NaOH содержится в 1 г образца. |
| … - | Сколько г NaOH содержится в 100 г образца или w (NaOH). |
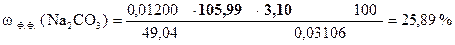
‚ ƒ „ …
| - | Сколько моль-экв H2SO4 содержится в 1 мл раствора. Столько же моль-экв Na2CO3 эквивалентно 1 мл раствора H2SO4. |
| ‚ - | Сколько г Na2CO3 эквивалентно 1 мл раствора H2SO4 или T(H2SO4/Na2CO3). |
| ƒ - | Сколько г Na2CO3 эквивалентно 3, 10 мл раствора H2SO4. Столько же г Na2CO3 содержится в навеске. |
| „ - | Сколько г Na2CO3 содержится в 1 г образца. |
| … - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
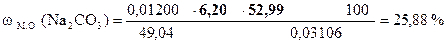
‚ ƒ „ …
| - | Сколько моль-экв H2SO4 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв H2SO4 содержится в 6, 20 мл раствора. Столько же моль-экв Na2CO3 содержится в навеске. |
| ƒ - | Сколько г Na2CO3 содержится в навеске. |
| „ - | Сколько г Na2CO3 содержится в 1 г образца. |
| … - | Сколько г Na2CO3 содержится в 100 г образца или w (Na2CO3). |
Задача 2.
На титрование щелочного раствора, содержащего ионы К+ и CO32-, в присутствии фенолфталеина расходуется 7, 52 мл, а в присутствии метилового оранжевого - 18, 25 мл 0, 2н раствора HCl (K = 1, 1150). Какие компоненты и в каком количестве содержатся в растворе?
| Дано: К0, 2Н = 1, 1150 V ф.ф. (HCl) = 7, 52 мл V м.о. (HCl) = 18, 25 мл |
| m =? |
Решение:
| KHCO3 | V1 ¹ 0 | 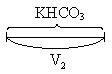
| |
| KOH | V1 ¹ V2 | 
| |
| K2CO3 | 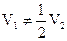
| 
| |
| KOH + K2CO3 | 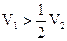
| 
| |
| … | K2CO3 + KHCO3 | 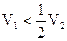
| 
|
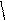
Вывод: в растворе содержится смесь K2CO3 + KHCO3
| Ф.Ф. | K2CO3 + HCl = KHCO3 + KCl
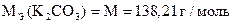
|
| М.О. | 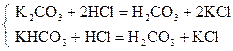

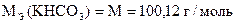
|
7, 52 мл - VHCl эквивалентный 1/2 K2CO3
7, 52 × 2 = 15, 04 мл - VHCl эквивалентный K2CO3
18, 25 - 15, 04 = 3, 21 мл - VHCl эквивалентный KHCO3

‚ ƒ
| - | Сколько моль-экв HCl содержится в 1 мл раствора. Столько же моль-экв K2CO3 эквивалентно 1 мл раствора HCl. |
| ‚ - | Сколько г K2CO3 эквивалентно 1 мл раствора HCl или T(HCl /K2CO3). |
| ƒ - | Сколько г K2CO3 эквивалентно 7, 52 мл раствора HCl. Столько же г K2CO3 содержится в навеске. |

‚ ƒ
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 15, 04 мл раствора. Столько же моль-экв K2CO3 содержится в навеске. |
| ƒ - | Сколько г K2CO3 содержится в навеске. |
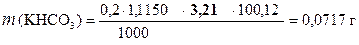
‚ ƒ
| - | Сколько моль-экв HCl содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв HCl содержится в 3, 21 мл раствора. Столько же моль-экв KHCO3 содержится в навеске. |
| ƒ - | Сколько г KHCO3 содержится в навеске. |
Задача 3.
Навеска вещества 0, 3810 г, содержащего ионы К+ и CO32-, растворена в воде. Полученный раствор титруют раствором H2SO4. T(H2SO4/KHCO3) = 0, 003780 г/мл. При титровании в присутствии фенолфталеина раствор обесцвечивается от прибавления первых капель кислоты, а на титрование в присутствии метилового оранжевого расходуется 32, 40 мл.
Что представляет собой вещество?
Вычислить процентное содержание основного продукта в нем.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
| Дано: T(H2SO4/KHCO3) = 0, 003780 г/мл V м.о. (H2SO4) = 32, 40 мл m Н = 0, 3810 г |
| w =? |
Решение:
| | KHCO3 | V1 = 0 | 
|
| KOH | V1 ¹ V2 | 
| |
| K2CO3 | 
| 
| |
 4 4
| KOH + K2CO3 | 
| 
|
 5 5
| K2CO3 + KHCO3 | 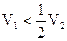
| 
|
Вывод: в растворе содержится KHCO3
| М.О. | 2KHCO3 + H2SO4 = 2H2CO3 + K2SO4
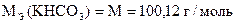
|
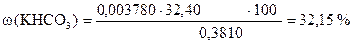
‚ ƒ
| - | Сколько моль-экв KHCO3 эквивалентно 32, 40 мл раствора H2SO4. Столько же г KHCO3 содержится в навеске. |
| ‚ - | Сколько г KHCO3 содержится в 1 г образца. |
| ƒ - | Сколько г KHCO3 содержится в 100 г образца или w (KHCO3). |
Задача 4.
Навеска натриевого щелочного вещества растворена в мерной колбе 100 мл. На титрование 20, 00 мл полученного раствора в присутствии фенолфталеина расходуется 12, 92 мл, а в присутствии метилового оранжевого - 26, 02 мл 0, 05100н раствора H2SO4. Что является основным продуктом в исследуемом веществе? Вычислить массу основного продукта в нем.
| Дано: m н = 0, 7092 г Сн(H2SO4) = 0, 05100 моль/л VK = 100, 00 мл Vn = 20, 00 мл V ф.ф. (H2SO4) = 12, 92 мл V м.о. (H2SO4) = 26, 02 мл |
| m =? |
Решение:
| NaHCO3 | V1 ¹ 0 | 
| |
| NaOH | V1 ¹ V2 | 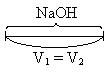
| |
| ƒ | Na2CO3 | 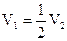
| 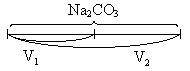
|
 4 4
| NaOH + Na2CO3 | 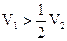
| 
|
 5 5
| Na2CO3 + NaHCO3 | 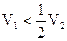
| 
|
Вывод: в растворе содержится Na2CO3.
| Ф.Ф. | 2Na2CO3 + H2SO4 = 2NaHCO3 + Na2SO4
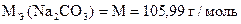
|
| М.О. | Na2CO3 + H2SO4 = H2CO3 + Na2SO4
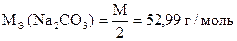
|
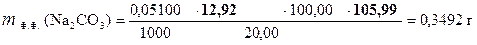
‚ ƒ „ …
| - | Сколько моль-экв H2SO4 содержится в 1 мл раствора. |
| ‚ - | Сколько моль-экв H2SO4 содержится в 12, 92 мл раствора. Столько же моль-экв Na2CO3 содержится в 20, 00 мл раствора. |
| ƒ - | Сколько моль-экв Na2CO3 содержится в 1 мл раствора. |
| „ - | Сколько моль-экв Na2CO3 содержится в 100, 00 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 100, 00 мл раствора. |
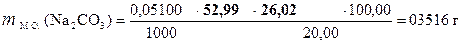
‚ ƒ „ …
| - | Сколько моль-экв H2SO4 содержится в 1 мл раствора. Столько же моль-экв Na2CO3 эквивалентно 1 мл раствора H2SO4. |
| ‚ - | Сколько г Na2CO3 эквивалентно 1 мл раствора H2SO4 или Т(H2SO4/ Na2CO3). |
| ƒ - | Сколько г Na2CO3 эквивалентно 26, 02 мл раствора H2SO4. Столько же г Na2CO3 содержится в 20, 00 мл раствора. |
| „ - | Сколько г Na2CO3 содержится в 1 мл раствора. |
| … - | Сколько г Na2CO3 содержится в 100, 00 мл раствора. |
|
|
