
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фізико - хімічні гомеопатичні механізми.
|
|
До фізико-хімічних механізмів кислотно-лужного гомеостазису відносяться буферні системи внутрішнього середовища організму й тканинні гомеостатичні обмінні процеси.
Буферні системи внутрішнього середовища організму. Основними буферними системами внутрішньоклітинної, міжклітинної рідини й крові є бікарбонатна, - фосфатна й білкова буферна системи, причому з останньої для крові особливо виділяють гемоглобіновий буфер.
Найбільше значення для підтримки рН міжклітинної рідини й плазми крові має бікарбонатна буферна система. Вугільна кислота в плазмі й міжклітинній рідині присутня в чотирьох формах: фізично розчиненого вуглекислого газу (СО2), вугільної кислоти (Н2СО3,), аніона карбонату (СО32-) і аніона бікарбонату (НСО3-). В умовах фізіологічного діапазону рН більше всього вміст бікарбонату, приблизно в 20 разів менше вмісту розчиненого вуглекислого газу й вугільної кислоти, а іон карбонату практично відсутній. Бікарбонат представлений у вигляді натрієвих і калієвих солей. Як уже вказувалося вище, константа дисоціації (К) є відношення:
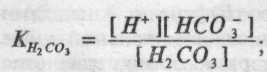
|
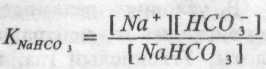
|
а для бікарбонату
Аніон НСО3 є загальним як для кислоти, так і для солі, а сіль дисоціює сильніше, тому цей аніон, утворюючись із бікарбонату, буде придушувати дисоціацію вугільної кислоти, тобто практично вся кількість аніона НСО3 у бікарбонатному буфері походить із NaHCO3. Отже:
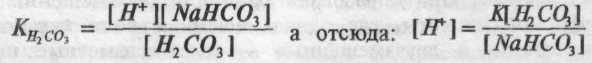
(формула Гендерсона, де К — константа дисоціації вугільної кислоти). У зв'язку з використанням негативного логарифма концентрації, формула, названа рівнянням Гендерсона-Гассельбаха, для бікарбонатного буфера прийняла вираження:
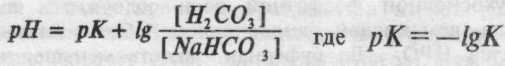
При фізіологічних значеннях рН відношення концентрації вуглекислоти до бікарбонату становить 1/20).
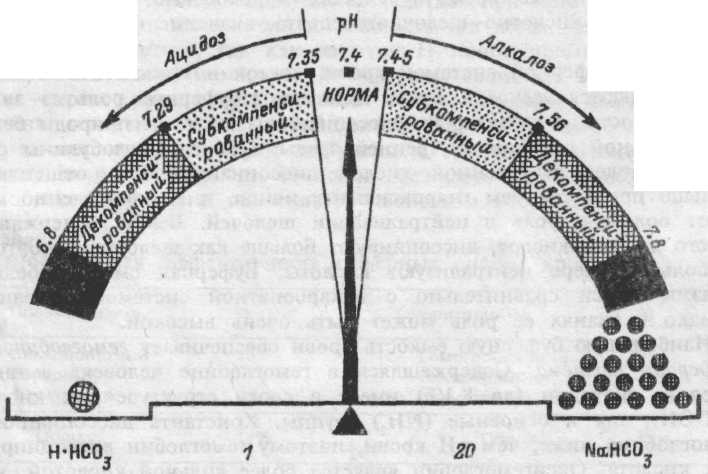
Кислотно-лужний стан.
Терези зображують співвідношення кислота/підстава або дихальна/недихальна компонента рівняння Гендерсона-Гассельбаха в нормі (1/20) і його зрушення, що ведуть до зсуву убік алкалозу або ацидозу.
В умовах взаємодії бікарбонатного буфера з кислотами відбувається їхня нейтралізація з утворенням слабкої вугільної кислоти. Вуглекислий газ, що з'являється при її розкладанні, видаляється через легені. Надлишок основ, взаємодіючи з бкарбонатним буфером, зв'язується з вугільною кислотою й приводить у кінченому рахунку до утворення бікарбонату, надлишки якого видаляються, у свою чергу, з крові через нирки.
Іншою буферною системою плазми крові є фосфатна буферна система. Вона утворена одно- і двозамісними шарами фосфорної кислоти, де однозаміщені солі є слабкими кислотами, а двозаміщені - мають помітні лужні властивості. Рівняння для фосфатного буфера наступне:
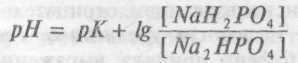
Двохосновної фосфатної солі втримується в плазмі в 4 рази більше, ніж кислої одноосновної. Загальним аніоном у цій системі є НРО4. Її буферна ємність менше, ніж бікарбонатної, тому що й фосфатів у крові втримується менше, ніж бікарбонатів. Принцип дії фосфатного буфера аналогічний бікарбонатному, хоча роль його в крові мала й, в основному, зводиться до підтримки концентрації бікарбонату при реакції буфера з надлишком вугільної кислоти. У той же час у клітинах й, особливо, при нирковій компенсації кислотно-лужного зрушення, значення фосфатного буфера велике.
Третьою буферною системою крові, клітин і міжклітинної рідини є білкова. Білки виконують буферну роль через їх амфотерності, а характер їхньої дисоціації залежить від природи білка й актуальної реакції внутрішнього середовища. При цьому глобуліни мають більше виражену кислу дисоціацію, тобто відщепляють більше протонів, чим гідроксильних іонів, і відповідно відіграють більшу роль у нейтралізації лугів. Білки, що містять багато діамінокислот, дисоціюють більше як луги, і тому в більшій мірі нейтралізують кислоти.Буферна ємність білків плазми крові порівняно з бікарбонатною системою невелика, однак у тканинах її роль може бути дуже високою.
Найбільшу буферну ємність крові забезпечує гемоглобінова буферна система. Амінокислота гістидин, що втримується, у гемоглобіні людини (до 8, 1%) має у своїй структурі як кислі (СООН), так й основні (NH2) групи. Константа дисоціації в гемоглобіна нижче, ніж рН крові, тому гемоглобін дисоціює як кислота. Оксигемоглобін є більше сильною кислотою, чим скорочений гемоглобін. При дисоціації оксигемоглобіну в капілярах тканин з віддачею кисню з'являється більша кількість лужно- реагуючих солей гемоглобіну, здатних зв'язувати Н-іони, що надходять із кислот тканинної рідини, наприклад, вугільної кислоти. Оксигемоглобін звичайно являє собою калієву сіль. При взаємодії кислот з калієвою сіллю оксигемоглобіну утвориться відповідна калієва сіль кислоти й вільний гемоглобін із властивостями дуже слабкої кислоти. Гемоглобін у тканинних капілярах зв'язує вуглекислий газ за рахунок аміногруп, утворюючи карбгемоглобін:
НВ- NH2+CO2 —»НВ- NHCOOH.
Для кислотно-лужного гомеостазису важливе значення має також обмін аніонів СІ- і НСО3 між плазмою й еритроцитами. Якщо в плазмі крові збільшується концентрація вуглекислоти, то утворюємий при дисоціації NaCl аніон СІ- входить в еритроцити, де утворить КСІ, а іон Na+, для якого мембрана еритроцита непроникна з'єднується з надлишком НСО3, утворюючи бікарбонат натрію, заповнюючи його нестачу у бікарбонатному буфері. При зниженні концентрації вуглекислоти в бікарбонатному буфері відбувається зворотний процес — аніони СІ виходять із еритроцитів і з'єднуються з надлишком Na+, що звільнився з бікарбонату, отже цим запобігається залужнювання плазми.
Буферні системи плазми крові й еритроцитів мають різну відносну ефективність. Так, ефективність буферних систем еритроцитів вище (за рахунок гемоглобінового буфера), чим плазми крові (табл. 13.2).
Відоме зменшення концентрації Н-іонів у напрямку клітина — міжклітинне середовище — кров. Це свідчить про те, що найбільшу буферну ємність має кров, а найменшу внутрішньоклітинне середовище. Утворені в клітинах при метаболізмі кислоти надходять у міжклітинну рідину тим легше, чим більше їх утвориться в клітинах, тому що надлишок Н-іонів підвищує проникність клітинної мембрани. У буферних властивостях міжклітинного середовища відіграє роль сполучна тканина, особливо колагенові волокна, відомі як " ацидофільні". На мінімальне нагромадження кислот вони реагують набряканням, поглинаючи дуже швидко кислоту й звільняючи від Н-іонів міжклітинну рідину. Ця здатність колагену пояснюється властивістю абсорбції.
Таблиця 13.2.
Відносна ефективність буферних систем крові
| Плазма крові | % | Еритроцити | % |
| Бікарбонатний Білковий Фосфатний | 35 7 1 | Гемоглобіновий Бікарбонатний Фосфатний | 35 18 4 |
| Загальна: | 43% | Загальна: | 57% |
Тканинні гомеостатичні обмінні процеси. Кислотно-лужний стан підтримується в межах фізіологічних значень рН і шляхом метаболічних перетворень у тканинах. Це досягається за рахунок сукупності біохімічних і фізико-хімічних процесів, які забезпечують: 1) втрату кислотних і лужних властивостей продуктів обміну речовин, 2) їхнє зв'язування в середовищах, що перешкоджає дисоціації, 3) утворення нових з'єднань, які більш легко нейтралізуються і виводяться з організму.
Так, наприклад, органічні кислоти можуть з'єднуватися із продуктами білкового обміну (бензойна кислота із гліцином) і тим самим втрачати кислі властивості. Надлишок молочної кислоти ресинтезується в глікоген, кетонових тіл - у вищі жирні кислоти й жири. Неорганічні кислоти нейтралізуються солями калію, натрію, що звільняються при дезамінірованні амінокислот, аміаком, що утворює амонійної солі. У дослідах на собаках з вилученими нирками (для виключення їхньої ролі) показано, що після внутрішньовенного введення кислоти 43% її кількості нейтралізується бікарбонатом плазми крові, 36% нейтралізуються за рахунок клітинного натрію, а 15% - за рахунок калію, який виходить із клітин. Основи нейтралізуються переважно молочною кислотою, утвореною із глікогену при залужнюванні мікрооточення клітин.
У підтримці внутрішньоклітинного рН відіграє роль обмін похідних імідазолу і його ізомеру піразолу. Особливості пʼ ятичленного кільця цих з'єднань визначають їхні амфотерні властивості, тобто здатність бути одночасно й донатором, і акцептором протонів. Імідазол здатний дуже швидко утворювати солі із сильними кислотами й лужними металами. Найпоширенішим з'єднанням імідазолу є α -амінокислота гістідін, що бере участь у кислотному й основному каталізі.
Сильні кислоти й луги можуть розчинятися в ліпідах, які володіють низькою діелектричною константою, що перешкоджає їхній дисоціації. Нарешті, органічні кислоти можуть піддаватися окислюванню з утворенням летючої слабкої вугільної кислоти.
|
|