
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Синдром острого повреждения легких
|
|
В 60-70-х годах разными авторами был описан синдром острой дыхательной недостаточности, возникающий на фоне интенсивной терапии у больных с острой кровопотерей, с тяжелой механической травмой, сепсисом, при применении экстракорпорального кровообращения и т.д. Этот патологический процесс именовался по-разному: “шоковым легким“ (Nickerson M., 1963; Hardaway R.M., 1969; Norlander O., 1975), “септическим легким“ (Collins J.A., 1969), “постперфузионным легочным синдромом“ (Королев Б.А., Шмерельсон М.Б., 1975), “гиповентиляционным диспноэ“ (Shumer N., 1971) и т.д. На длительное время за ним укрепилось название - “респираторный дистресс-синдром взрослых“, предложенное D.G. Ashbaugh (1967). Впоследствии вместо " взрослых" в название введено определение " острый", поскольку было доказано, что развитие РДС у новорожденных может быть связано с теми же причинами, что и у взрослых.
Классическое клиническое описание ОРДС, описанное D.G. Ashbaugh с коллегами почти 40 лет назад, предусматривает наличие диспноэ, тахипноэ, цианоза, ригидных легких, диффузной альвеолярной инфильтрации. Частота развития ОРДС варьирует от 1, 5 до 75 случаев на 100000 населения в год, что обусловлено различными подходами к его диагностике.
В целом принято считать, что ОРДС характеризуется прогрессирующей гипоксемией и внутрилегочным шунтированием крови, двусторонней инфильтрацией легочных полей на фронтальной рентгенограмме грудной клетки, быстрым снижением податливости легочной ткани, легочной гипертензией при отсутствии признаков левожелудочковой недостаточности. По мере изучения причин развития и патогенеза острого респираторного дистресс-синдрома возникла концепция, согласно которой под ним стали понимать крайнее проявление более широкого процесса, именуемого острым повреждением легких (ОПЛ).
ОПЛ возникает на основе диффузного повреждения эндотелия легочных капилляров под воздействием экзогенных и эндогенных веществ. Развитие тяжелой острой воспалительной реакции и нарушение целостности альвеоло-капиллярной мембраны имеют огромное значение в его патогенезе. Фактически, ОПЛ (ОРДС) является проявлением синдрома общего реактивного воспаления, которое, как сегодня полагают, является основой полиорганной несостоятельности.
Патогенез развития ОПЛ и ОРДС во многом еще не изучен, однако ряд важных его звеньев выделить вполне возможно (рис. 35.1):
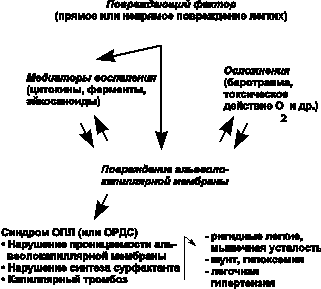
Рис. 35.1. Патогенез ОРДС
- снижение капиллярного кровотока, образование и задержка легочным эндотелием микроагрегатов тромбоцитов и микроэмболов с выходом хемоаттрактантов;
- деструкция задержанных продуктов с образованием биологически агрессивных веществ, повреждающих интерстиций;
- сужение и тромбоз сосудов, часто ведущих к пульмональной гипертензии;
- проникновение богатой протеином жидкости в эктравазальное пространство, отражающее пульмональный отек, не связанный с нарушением функции левого желудочка;
- массивный альвеолярный коллапс, обычно сочетающийся с потерей сурфактанта и снижением растяжимости.
Считается, что в начальной фазе синдрома на фоне замедления кровотока в зоне микроциркуляции легких и образования сначала микроагрегатов тромбоцитов, а затем и микроэмболов происходит адгезия и активация нейтрофилов. Нейтрофилы фиксируются на поврежденном эндотелии легочных капилляров и затем проникают в интерстициальное пространство и просвет альвеол. Из задержанных в легком клеток, главным образом нейтрофилов, освобождаются цитокины, ферменты (эластаза, коллагеназа) и другие вещества, которые повреждают альвеоло-капиллярную мембрану и интерстиций, растворяя эластин, коллаген, фибронектин и т.д. Альвеолярные макрофаги также секретируют цитокины, которые действуют локально, стимулируют хемотаксис и активируют нейтрофилы. Нарушение легочного кровообращения может быть также связано с ролью легких в метаболизме медиаторов воспаления.
Цитокины (фактор некроза опухоли, интерлейкины) и другие провоспалительные биологически активные вещества являются важнейшими медиаторами воспалительной реакции, инициирующими и усиливающими воспалительный ответ при ОПЛ. Провоспалительные цитокины продуцируются в легких нейтрофилами и альвеолярными макрофагами, эпителиальными клетками и фибробластами. Дальнейшее патологическое воздействие оказывают продукты каскада комплемента, лизосомальные ферменты и биогенные амины, продукты деградации фибриногена и метаболизации арахидоновой кислоты с появлением в циркулирующей крови таких субстанций (эйкосаноиды), как простагландины PgE2 и PgF2, лейкотриены, тромбоксан ТхА2, ФАТ - фактор активации тромбоцитов. Эйкосаноиды не только еще больше увеличивают проницаемость мембраны, но и обладают выраженной бронхо- и вазомоторной активностью; они вызывают бронхиолоспазм, спазм легочных вен и усиливают тромбообразование. Свободные радикалы, выделяющиеся вместе с ферментами, повреждают клеточные мембраны, вызывая пероксидацию липидов, из которых состоят мембраны, а также разрушают гиалуроновую кислоту, связывающую массу соединительной ткани. Проницаемость мембраны возрастает еще более, и этот эффект усиливается при ингаляции 100% кислорода.
Следствием распространенного повреждения микрососудов становится перемещение значительного количества воды и белка в интерстициальное пространство. Подтверждением этого является нарастание оттока из таких легких тканевой жидкости, богатой протеином: концентрация белка в оттекающей от легких лимфе достигает уровня содержания его в плазме крови. В конечном счете, вследствие нарушения целостности (проницаемости) альвеолокапиллярной мембраны развивается некардиогенный отек легких. Прослеживается прямая связь между степенью функциональной легочной недостаточности в отношении газообмена и внесосудистым объемом воды в паренхиме легких. Альвеолы при этом коллабируются вследствие воспалительного инфильтрата, крови, отечной жидкости, нарушения функции сурфактанта, а также сужения мелких воздухопроводящих путей из-за интерстициального отека и бронхиальной обструкции. В острой фазе синдрома происходят также деструкция альвеолоцитов, сладжирование бронхиальных и альвеолярных клеток, которые при попадании в просвет альвеолы формируют богатые протеином гиалиновые мембраны.
Респироны постепенно заполняются отечной жидкостью; поэтому вначале легочная паренхима представляет мозаику воздушных, коллабированных и отечных конечных легочных единиц. Так, например, при КТ-исследовании легких (рис. 35.2) больного с ОРДС выявляется сочетание коллабированных областей с относительно интактными и вентилируемыми областями. Причем размер и расположение этих зон зависят от используемого ПДКВ, положения тела и других факторов.

Рис. 35.2. Компьютерная томография легких больного с ОРДС
Газообмен возможен лишь в непораженных зонах или в участках легких, потенциально включаемых в вентиляцию, например, при использовании ПДКВ. В действительности часто только небольшие участки легкого продолжают вентилироваться. На их долю может приходиться меньше 20% нормального легочного объема. Перфузия невентилируемых областей является причиной большого шунта справа налево, который может составлять более 60% сердечного выброса и являться главной причиной артериальной гипоксемии при ОПЛ.
Таким образом, в результате патологических изменений возникает тяжелое несоответствие между вентиляцией и перфузией, ведущее к возникновению шунта справа налево, часто с тяжелой артериальной гипоксемией. Если повреждение капиллярного русла носит системный характер, нарушение доставки кислорода в ткани и нарушение его утилизации в митохондриях приводят к диффузному гипоксическому клеточному повреждению и развитию полиорганной несостоятельности.
Снижение растяжимости легких при ОПЛ происходит вследствие нарушения функции сурфактанта на фоне альвеолярного отека, воспаления, фиброза, влияющих на эластичность легочной ткани. Кроме того, снижение общей растяжимости легких, по крайней мере, отчасти, связано с уменьшением зоны легких, доступных для вентиляции.
Легочная гипертензия обычно развивается у больных с ОПЛ вследствие вазоконстрикции, тромбоза, периваскулярного отека, воспаления, возможного интерстициального фиброза. При выраженной легочной гипертензии может проявиться правожелудочковая недостаточность. Она может быть также следствием сниженной доставки кислорода, неадекватной водной нагрузки, аритмии, истощения, действия миокард-дистрофического фактора на фоне развития системного капиллярного повреждения.
Клиника и диагностика синдрома острого повреждения легких. В 1992 г. на Американо-Европейской согласительной конференции был сформулирован подход к ОРДС как форме (и до определенной степени стадии) острого паренхиматозного повреждения легких. Через два года (1994 г.) на подобной же конференции критериями ОПЛ и ОРДС были определены следующие признаки:
- острое начало;
- двусторонняя инфильтрация на фронтальной рентгенограмме легких;
- нарушение оксигенации крови в легких: PO2/FiO2 меньше 300 мм рт. ст. для ОПЛ, меньше 200 мм рт. ст. для ОРДС;
- ДЗЛК< 18 мм рт. ст.
В связи с тем, что данный подход является довольно упрощенным, в практической работе используют и другие диагностические признаки, объединяемые в специальные шкалы. Например, критериями оценки по шкале J.F. Murrey являются данные рентгенологического исследования легких, глубина расстройств дыхательной функции по коэффициенту оксигенации PaO2/FiO2, величина ПДКВ в см вод. ст. и статическая податливость легких в мл/см вод. ст. (табл. 35.1). Основная цель этой шкалы - объективизация оценки выраженности функциональных изменений при синдроме острого легочного повреждения, в том числе при проведении больному респираторной поддержки в режиме принудительной ИВЛ.
Таблица 35.1.
Градация функциональных изменений по J.F. Murrey и соавт. (1988)
| Балл | РаО2/FiO2 | Рентгенография | ПДКВ, см вод. ст. (при ИВЛ) | Податливость, мл/см вод. ст. |
| > 300 | Нет | < 6 | > 80 | |
| 229-225 | 1 квадрант | 6-8 | 79-60 | |
| 224-175 | 2 квадранта | 9-11 | 59-40 | |
| 174-100 | 3 квадранта | 12-14 | 39-20 | |
| < 100 | 4 квадранта | > 14 | < 20 |
Примечание: 0 ‑ повреждения нет; 2, 5 ‑ умеренное повреждение; > 2, 5 тяжелый синдром острого повреждения легких
Клинические факторы риска развития ОПЛ (табл. 35.2) можно разделить на две группы: а) связанные с прямым повреждением легких (аспирация, диффузная легочная инфекция, утопление, контузии легких), б) вызывающие непрямое повреждение легких (сепсис, гипотензия, тяжелая неторакальная травма, гиперперфузия, искусственное кровообращение и др.).
Таблица 35.2.
Факторы риска острого повреждения легких (ОРДС)
| Прямые | Непрямые |
| Аспирация Пневмония Контузия легких Ингаляционные повреждения Жировая эмболия (множественные переломы двух и более трубчатых костей) | Сепсис Тяжелая неторакальная травма Массивные гемотрансфузии Острый панкреатит Ожоги Геморрагических шок Передозировка некоторых лекарственных препаратов (опиаты, барбитураты) ДВС |
Пациенты с ОРДС вследствие прямого повреждения легких имеют, как правило, лучший клинический прогноз, чем те, у которых патологический процесс носит системный характер.
Прямые факторы риска развития ОПЛ и ОРДС инициируют воспалительный каскад в легких либо путем ингаляционного повреждения, либо путем эмболизации микрососудистого русла (амниотическая эмболия). Все это непосредственно повреждает альвеолокапиллярную мембрану. Проявления ОРДС зависят от тяжести начального повреждения легких, общих резервов больного и развития ятрогенных осложнений (аспирация желудочным содержимым, баротравма, токсическое действие кислорода).
При системном повреждении микроциркулятороного русла воспалительный процесс в легких может рассматриваться как одно из проявлений системной воспалительной реакции (СВР).
Особенности нарушений легочного газообмена и общая клиническая картина примерно соответствуют морфологическим изменениям в легочной паренхиме, а потому определяют стадийность развития ОПЛ. Морфологически процесс развития часто разделяют на три стадии: экссудативную, пролиферативную и фиброзную. Клинические симптомы ОПЛ неспецифичны и могут быть представлены нарастающей одышкой и признаками гипоксии с повышением давления на вдохе, прогрессирующей инфильтрацией на рентгенограмме легких, артериальной гипотензией неясного происхождения, которые выявляются через 12-24 ч после действия этиологического фактора. Реже это легочное осложнение развивается в первые часы (аспирация кислого желудочного содержимого), но еще реже спустя 2-3 суток после воздействия повреждающих факторов на легкие больного.
Условно экссудативный период разделяют на IV стадии. В первой (начальной) состояние больного средней тяжести, признаки острой дыхательной недостаточности не выражены. Сдвиги показателей внешнего дыхания, если они исследуются, соответствуют примерно обычной послеоперационной динамике, а эффективность оксигенации снижена незначительно (РаО2 около 70 мм рт. ст.). При перкуссии легких выявляется умеренное притупление в нижне-средних отделах, при аускультации - жесткое дыхание с небольшим количеством хрипов. На рентгенограмме определяется усиление легочного рисунка, двусторонние мелкоочаговые тени. Тенденция к тахикардии не внушает беспокойства, системное АД соответствует уровню, характерному для данного пациента. Морфологическая картина на этой стадии складывается из интерстициального отека, мозаичных нарушений кровообращения в легких. Эти изменения обычно разрешаются при быстрой нормализации кровообращения (восстановление эффективного ОЦК и микроциркуляции).
Дальнейшее развитие морфологических изменений в легких проявляется клиникой развития дыхательных расстройств (вторая стадия). Состояние больного тяжелое, у некоторых пациентов отмечают угнетение сознания, у других - чувство страха, беспокойство. Одышка, тахипноэ при разговоре заметно нарастают. У многих пациентов при отсутствии анемии - отчетливый цианоз. При перкуссии легочных полей улавливаются неравномерно локализованные зоны притупления перкуторного звука, при аускультации легких - заметное ослабление дыхания в нижних отделах на фоне ограничения подвижности легочного края. Функциональные нарушения характеризуются уменьшением ЖЕЛ. Наблюдается резкое снижение статической легочно-торакальной растяжимости (ниже 60-50 мл/см вод. ст. и более), значительно возрастает работа дыхания для преодоления эластического сопротивления легких. Если на этом фоне по тем или иным показаниям выполняют бронхоскопию, бронхиальное дерево оказывается практически свободным от мокроты. При этом выявляется значительная гипоксемия (менее 60 мм рт. ст.), нередко необычная для данного этапа послеоперационного периода, которая не купируется оксигенотерапией и сочетается с предельным снижением РаСО2 (до 30 мм рт. ст. и ниже). Клинические проявления в этой стадии уже сопровождаются типичной рентгенологической картиной: расширение и ячеистая деформация сосудистых теней, вуалеобразное затенение легочных полей. Группа признаков со стороны сердечно-сосудистой системы представлена стойкой тахикардией, часто умеренной артериальной гипотензией, с относительно невысоким ЦВД и легочным капиллярным давлением 18 мм рт. ст. и ниже. При этом давление в системе легочной артерии, как правило, все же повышено.
Морфологические изменения во второй стадии заключаются в значительном увеличение плотности и полнокровии легких, деформации альвеол с утолщением их стенок, полнокровии сосудов межальвеолярных перегородок и стазом крови в капиллярах. В целом наблюдается картина интерстициального отека и начинающегося внутриальвеолярного отека легких.
На следующей III стадии сознание больного обычно заторможено. Наблюдается тахипноэ с малыми дыхательными объемами, диффузный цианоз кожных покровов, имеются признаки повышенной " работы дыхания". При аускультации выслушиваются зоны " амфорического дыхания", отмечается выраженная артериальная гипоксемия, нарастающая гиперкапния. На фронтальной рентгенограмме легких определяются множественные сливающиеся тени (" снежная буря"), может быть выпот в плевральных полостях.
Отмечается выраженная тахикардия, часто артериальная гипертензия, давление в системе легочной артерии высокое, часто сопровождается перегрузкой правых отделов сердца.
На этой стадии морфологическая картина заключается в следующем: белок и форменные элементы в альвеолах, отслаивание эпителия и утолщение альвеолярной стенки, микротромбы в сосудах, множественные кровооизлияния в ткань легкого и участки ателектазов. Отмечаются воспалительные очаги по типу серозно-десквамационной пневмонии, наблюдается выраженная лимфоидно-клеточная гиперплазия перибронхиального аппарата, увеличивается коллагенообразование в септах, окруженных нейтрофилами и макрофагами.
В заключительной IV стадии сознание пациента обычно нарушено (сопор). Аускультативно выслушиваются множественные разнокалиберные хрипы. Отмечается артериальная гипоксемия и гиперкапния, которые корректируются только " агрессивными" методами респираторной поддержки. На рентгенограмме легких выявляется затемнение больших участков (доли, сегмента), рентгенологические признаки отека. Давление в системе легочной артерии высокое, что часто приводит к развитию правожелудочковой недостаточности.
Морфологически на этой стадии определяется картина альвеолярного отека, фибрин в альвеолах, гиалиновые мембраны в альвеолярных стенках, микротромбы в сосудах, фиброз легочной ткани, в зонах ателектазов появляются участки геморрагий, которые, сливаясь между собой, образуют распространенные поля кровоизлияний.
Экссудативный период ОПЛ сменяется пролиферативным, если больной переживает стадию ОДН. Последствия и исход ОПЛ и ОРДС - бронхопневмония, микроабсцессы легких и так называемые гиалиновые мембраны - наблюдаются только у тех больных, которые пережили несколько дней. Одновременно приоритетное значение приобретают аутоиммунные процессы, которые формируют диффузный легочный фиброз со всеми трудностями преодоления связанных с этой патологией расстройств.
ОРДС в ранней фазе следует дифференцировать с левожелудочковой сердечной недостаточностью, пневмонией, легочным кровотечением с распространенной аспирацией крови в бронхиальное дерево.
У пациентов с гемодинамическим альвеолярным отеком легких, развивающимся постепенно, клинико-рентгенологические проявления иногда очень близки с ОЛП. Анамнез больного, размеры и конфигурация сердечной тени, выявление третьего тона при аускультации сердца, а также быстрая динамика рентгенологических данных под влиянием диуретиков или ультрафильтрации позволяют утверждать, что в данном случае изменения в легких связаны скорее с застойной сердечной недостаточностью, чем с ОПЛ. Решающее значение для диагностики может дать измерение легочного капиллярного давления после постановки в легочную артерию катетера Swan-Ganz. За редким исключением, давление заклинивания ниже 18 мм рт. ст. подтверждает диагноз ОЛП, а не гемодинамического отека.
В некоторых случаях быстро прогрессирующая пневмония смешанного генеза (вирусно-бактериальная, микоплазменная) без проведения специального исследования мокроты с помощью специальных методов исследования нередко ошибочно рассматривается как “шоковое легкое”.
Стойкое сохранение теней на рентгенограмме, особенно при их односторонней локализации, может свидетельствовать о поражении легких, связанном с тромбоэмболией или тромбозом в бассейне легочной артерии.
Принципы интенсивной терапии. Терапия ОПЛ и ОРДС включает в себя лечение основного заболевания и синдромальную (поддерживающую) терапию. Поддерживающая терапия включает в себя меры, направленные на коррекцию дыхательной и сердечно-сосудистой систем, функции почек, системы гемостаза, желудочно-кишечного тракта и нутриционную поддержку.
Важнейшим и наиболее разработанным направлением терапии ОПЛ и ОРДС является респираторная поддержка, целью которой является:
- обеспечение необходимой доставки кислорода к жизненно важным органам и достаточная элиминация углекислоты для поддержания гомеостаза;
- облегчение работы дыхательной мускулатуры;
- избежание усугубления повреждения легких или задержки выздоровления.
Данные, объективно подтверждающие преимущества одного режима вентиляции перед другими, на сегодня отсутствуют. Однако влияние искусственной вентиляции на поврежденные легкие и другие системы при этой патологии изучено довольно неплохо.
В отличие от более ранних представлений об ОРДС, как о диффузном процессе, постепенно приводящем к увеличению эластического сопротивления, на сегодня общепризнан факт гетерогенности поражения при нем легочной паренхимы. Например, в тяжелых случаях ЖЕЛ снижается до 20-30% от нормы, однако механические свойства участков легочной паренхимы, сохраняющих воздушность, гораздо более близки к норме, чем это предполагалось ранее.
Гипоксемия при ОПЛ может быть уменьшена путем увеличения вдыхаемой концентрации О2, увеличения среднего давления в альвеолах и давления в конце выдоха. Каждое из этих направлений имеет свои достоинства и недостатки. Вероятность негативных последствий увеличивается пропорционально продолжительности вентиляции. Наиболее часто вызванные ею повреждения легких реализуются в баротравме (внеальвеолярный газ), травме объемом (диффузное поражение альвеол из-за перерастяжения), ателектазах (поражение легких из-за чередования расправления и коллапса альвеол дыхательным объемом), биотравме (физический стресс механической вентиляцией, вызывающий высвобождение медиаторов воспаления).
В клинической практике при ОПЛ у взрослых встречаются все виды баротравмы: интерстициальная эмфизема, напряженные кисты, газовая эмболия, изменения, напоминающие бронхопульмонарную дисплазию. Наиболее серьезная форма повреждения легкого - пневмоторакс. Наиболее важными клиническими факторами риска его развития являются максимальное трансальвеолярное растягивающее давление и длительность проведения респираторной поддержки. В раннем периоде ОПЛ легкие способны выдерживать достаточно высокие давления, тогда как позднее коллагеновые структуры легочной паренхимы подвергаются неравномерному разрушению, что и приводит к нарастанию частоты осложнений.
Регионарное перерастяжение обычно возникает при использовании статического давления в дыхательных путях, превышающего 30 см вод. ст. Паттерны вентиляции, чрезмерно растягивающие альвеолы, вызывают или усугубляют тканевой отек и повреждение. Считается, что максимальное альвеолярное давление (давление плато в течение инспираторной задержки в отсутствии потока) должно быть меньше 35 см Н2О. Это может потребовать ограничения ПДКВ (меньше 15 см Н2О) и дыхательного объема (менее 8 мл/кг). При этом допускается более низкий уровень сатурации (90%) и более высокий - РСО2 (допустимая гиперкапния).
Удлиненное инспираторное время (без развития ауто-ПДКВ) может увеличивать среднее альвеолярное давление без изменения максимального альвеолярного давления. Это может помочь рекрутировать медленно вентилируемые альвеолы и увеличить время смешивания газа, тем самым улучшая вентиляционно-перфузионные отношения и артериальное РО2. Действие этого приема, с точки зрения повреждения легких, не известно, также как и его влияние на исход ОПЛ.
Развитие при ОРДС альвеолярного коллапса и соответствующее уменьшение функциональной емкости легких наиболее вероятно в течение выдоха, когда трансальвеолярное давление наиболее низкое. Применение ПДКВ может предотвращать коллапс, тем самым рекрутируя альвеолы и увеличивая функциональную остаточную емкость легких. Повторяющееся наполнение поврежденных альвеол воздухом на фоне предшествующего их коллапса является важным компонентом дальнейшего повреждения легких при проведении искусственной вентиляции. Доказано, что эта тактика приводит к улучшению вентиляционно-перфузионных отношений, уменьшает шунт, и, таким образом, снижает необходимость использования токсических доз кислорода. Растяжимость при этом может увеличиваться, поскольку альвеолы не коллабируются на выдохе, что улучшает механические свойства легких. Чрезмерное ПДКВ, однако, может перерастягивать альвеолы и уменьшать растяжимость легких.
Выбор оптимальной величины ПДКВ, исходя из возможности нежелательных эффектов этого режима, основывается на показателях газообмена (РО2, РСО2, SаО2), достижении наивысшей величины статической податливости легких или уровне доставки кислорода тканям. Небольшие цифры ПДКВ (5-7 см Н2О) используются почти всегда. Такой его величины обычно достаточно, чтобы предотвратить альвеолярный коллапс.
Влияние ПДКВ на газообмен проявляется медленно в течение нескольких часов. Уровень ПДКВ в 15-20 см Н2О обычно не используют из-за риска перерастяжения относительно здоровых зон легких. У больных, которые не требуют сопутствующей вентиляционной поддержки, экспираторное давление можно обеспечить с помощь режима СРАР.
Если используется удлиненный вдох, необходимо иметь в виду возможность развития внутреннего ПДКВ. Оно воздействует на коллабированные альвелы таким же образом, как и наружное. Внутреннее (ауто-) ПДКВ, однако, оценить сложно. При неадекватной установке длительности вдоха оно может влиять на параметры вентиляции. При объемной вентиляции ауто-ПДКВ увеличивает пиковое давление, а при вентиляции с контролем по давлению - уменьшает дыхательный объем. Вследствие этого на преднамеренное создание внутреннего ПДКВ необходимо идти с большой осторожностью.
Использование кислорода повышает его альвеолярное парциальное давление и, соответственно, артериальное РО2. Однако эффект от увеличения FiО2 становится менее выражен по мере того, как прогрессирует ОПЛ и нарушаются вентиляционно-перфузионные отношения. К сожалению, продолжительное использование высоких концентраций кислорода может приводить к патологическим изменениям в легких, похожих на те, которые происходят при ОРДС. Большинство клиницистов наиболее оптимальным уровнем FiО2 считают 40%, предельно допустимым - 60%.
В тех случаях, когда имеются критические значения показателей газообмена и механики дыхания, а также наблюдается рассинхронизация работы аппарата с дыханием пациента, предпочтение в респираторной поддержке должно быть отдано принудительной ИВЛ с седацией и релаксацией больного. Дыхательные мышцы при этом имеют возможность восстановиться, поскольку вентилятор обеспечивает все энергетические затраты по обеспечению вентиляции. В то же время использование миорелаксантов для улучшения газообмена не всегда является оправданным. Из-за снижения тонуса диафрагмы дополнительно могут нарушаться вентиляционно-перфузионные отношения. Кроме того, применение их повышает риск тромбоэмболических и инфекционных осложнений.
Проведение седации или релаксации может также потребоваться при использовании неестественного дыхательного паттерна (длительный вдох) или при высоком пиковом давлении. Если повреждение легких не очень тяжелое или отмечается положительная динамика в состоянии больного, используется ВВЛ с постепенным снижением вентиляционной поддержки, чтобы пациент брал на себя часть работы по обеспечению вентиляции. При частичной поддержке, как правило, наблюдается меньшее пиковое давление и требуется меньше седативных препаратов.
Таким образом, можно выделить ряд положений (приоритетов), которые следует использовать при проведении респираторной поддержки при ОПЛ.
1. Избежание токсичных концентраций кислорода, применение их в течение непродолжительного времени и при крайней необходимости. В качестве альтернативы сначала можно прибегнуть к увеличению инспираторных давлений, улучшению функции сердечно-сосудистой системы, стимуляции диуреза и т. п.
2. Поддержание минимального среднего давления в дыхательных путях, которое позволяет добиваться нормальной оксигенации без использования токсических концентраций кислорода. При заданном уровне минутной вентиляции среднее давление в дыхательных путях может быть увеличено путем создания ПДКВ или за счет увеличения времени вдоха.
3. При снижении пикового давления в дыхательных путях до безопасного уровня допустима пермиссивная гиперкапния, вентиляция легких с контролем по давлению и объемная вентиляция с ограничением максимального давления. Предельно допустимым является максимальное пиковое давление паузы вдоха около 35 см Н2О.
4. Обоснованное использование фармакологическое угнетения сознания и мышечного тонуса пациента с обязательным мониторингом состояния больного. При этом руководствуются показателями доставки кислорода, степенью гипоксемии, переносимостью данного режима ИВЛ.
При терапии ОРДС в последние годы все шире используют различные режимы ИВЛ с контролем по давлению (PC-IRV или CMV(PC), SIMV (PC) BIPAP, APRV). PC-IRV (вентиляция, контролируемая по давлению с инвертируемым отношением вдоха к выдоху) - представляет собой режим респираторной поддержки, обеспечивающий удлинение времени вдоха. Достоинствами его является наличие жесткого контроля пикового давления, высокая скорость инспираторного потока, возможность обеспечения высокого среднего давления в течение дыхательного цикла за счет подбора степени инверсии, пикового давления и уровня ПДКВ. По возможности подбор параметров вентиляции следует проводить на основе анализа кривой объем-давление (см. гл. 6.1).
При проведении контролируемой ИВЛ у больных с ОПЛ необходимо обязательно использовать влияние на газообмен положения больного. Во время такой респираторной поддержки наряду с традиционно используемым поворотом пациента на бок рекомендуется поворачивать его на живот (prone position). Улучшение газообмена при этом может быть обусловлено следующими механизмами:
- повышением остаточной емкости легких;
- изменением региональных движений диафрагмы;
- перераспределением перфузии в сторону лучше вентилируемых респиронов;
- улучшением очищения бронхиального дерева от секрета.
Другие аспекты интенсивной терапии включают адекватный туалет легких, предупреждение аспирации, уход за эндотрахеальной трубкой. Предпочтительно использование манжеты низкого давления, удаление секрета над манжетой и проведение трахеостомии, если необходима длительная вентиляция (больше 7-15 дней).
Лечение по поддержанию сердечно-сосудистой системы включает в себя инфузионную терапию, использование вазоактивных препаратов, инотропных средств. Одной из задач этой терапии является уменьшение отека легких, развитие которого может быть вызвано повышением давления в легочных капиллярах, нарушением проницаемости альвеолярно-капиллярной мембраны, снижением онкотического давления плазмы крови, дисфункцией работы лимфатического аппарата.
Оптимальный водный и гемодинамический режим при ОПЛ и ОРДС не отработан. Наиболее часто стремятся обеспечить нормоволемию с ограничением вводимой жидкости и снижением легочного давления. Основная цель такого подхода - снижение количества отечной жидкости в легких, улучшение за счет этого газообмена и ускорение выздоровления. Противоположный подход - использование агрессивной волемической терапии с инотропной поддержкой для обеспечения повышенных значений доставки кислорода.
Диагностика и лечение аритмий - неспецифическое, но важное направление лечения, способствующее улучшению транспорта кислорода. Сердечный выброс может быть также значительно улучшен при контроле частоты пульса или при восстановлении синусового ритма у пациентов с трепетанием или мерцанием предсердий.
Для улучшения газообмена в легких может быть также применена ингаляция оксида азота и высокочастотная вентиляция (ВЧВ). Экстракорпоральная мембранная оксигенация (ЭКМО) для больных с тяжелой гипоксемической недостаточностью в настоящее время используется в качестве дополнения к традиционным методам лечения. Возможные осложнения (кровотечение) и недостаточная производительность большинства мембранных оксигенаторов ограничивают показания к широкому применению ЭКМО у больных с ОПЛ.
Окончательного мнения об эффективности сурфактанта, ингаляции простациклина у взрослых не сформировано, хотя определенное положительное влияние их на течение ОПЛ зафиксировано. При респираторном дистресс-синдроме новорожденных сурфактантная терапия оказывает очень хороший эффект. Назначение экзогенного сурфактанта может потенциально поддержать стабильность альвеол, особенно во время выдоха, расширить вентилируемую зону и уменьшить движущие силы развития отека легких в этих условиях. Сурфактант является также важным медиатором функции иммунных клеток, хотя это менее изученное действие, чем снижение поверхностного натяжения.
Глюкортикоиды могут ингибировать индуцированную комплементом агрегацию нейтрофилов и продукцию туморнекротизирующего фактора макрофагами. Доказательств эффективности применения больших их доз при ОРДС не получено. Имеются немногочисленные сведения об эффективности небольших доз кортикостероидов в поздней стадии за счет уменьшения активности процессов фиброзирования. Эффективность других препаратов, ингибиторов провоспалительных медиаторов (пентоксифиллин, моноклональные антитела, ингибиторы циклоксигеназы - кетопрофен и многие др.) также не доказана, хотя исследования в этом направлении активно продолжаются.
Учитывая значение эндогенной интоксикации в генезе ОЛП после травм и хирургических вмешательств, рассматривается возможность применения методов экстракорпоральной детоксикации (см. гл. 6.7), в частности гемофильтрации. При ее своевременном использовании удается добиться уменьшения количества внесосудистой воды в легких и дегидратации легочной ткани, а также удаления медиаторов, определяющих повышение проницаемости легочных капилляров.
Нутриционная поддержка направлена на предотвращение дальнейшего прогрессирования полиорганной дисфункции и депрессии иммунитета. Она должна быть начата в максимально ранние сроки. Одновременно следует осуществлять специфическую профилактику стрессовых язв. Необходимо также проводить коррекцию гемостаза, контролировать процесс развития инфекционных осложнений, обеспечить профилактику тромбоза глубоких вен.
|
|