
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В изолированной системе самопроизвольно могут протекать процессы, сопровождающиеся увеличением энтропии
|
|
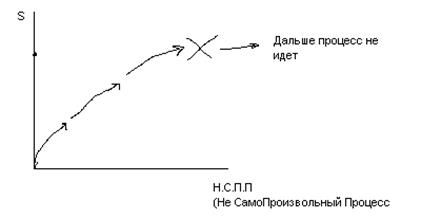
Предел протекания таких процессов – минимальное значение S
При абсолютном нуле – энтропия =0 (3й закон термодинамики)
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при абсолютном нуле температуры. Является одним из постулатов термодинамики.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».

или
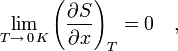
где x — любой термодинамический параметр.
Заметим, что третье начало термодинамики относится только к равновесным состояниям
Энтропия (от греч. ἐ ν τ ρ ο π ί α — поворот, превращение) — понятие, впервые введенное в термодинамике для определения меры необратимого рассеивания энергии. Термин широко применяется и в других областях знания: в статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; в теории информации как мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы, в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы; её существование постулируется вторым началом термодинамики.
обобщение на случай произвольного квазистатического процесса выглядит так:

15. Энергия Гельмгольца. Ее изменение как критерий протекания процессов при V=const и T=const
Свободная энергия Гельмгольца (или просто свободная энергия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
|
|
