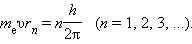Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 4.2. Атомная физика.
|
|
Основные понятия и термины по теме:
Модель атома. Постулаты Бора. Квантование энергии.
План изучения темы:
- Строение атома: планетарная модель и модель Бора. Опыты Резерфорда.
- Квантовые постулаты Бора.
- Поглощение и испускание света атомом. Квантование энергии.
Краткое изложение теоретических вопросов:
На основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10–10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него.

Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение

Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
|
Теория Бора при описании поведения атомных систем не отвергла полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра. Классическая ядерная модель атома Резерфорда в теории Бора была дополнена идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории он был хорошо изучен экспериментально. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
|
Для серии Бальмера m = 2, n = 3, 4, 5,.... Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4,.... Постоянная R в этой формуле называется постоянной Ридберга. Ее численное значение R = 3, 29·1015 Гц. До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода (и ряда других атомов), оставались непонятными.
Постулаты Бора определили направление развития новой науки – квантовой физики атома. Но они не содержали рецепта определения параметров стационарных состояний (орбит) и соответствующих им значений энергии En.
Правило квантования, приводящее к согласующимся с опытом значениям энергий стационарных состояний атома водорода, Бором было угадано. Он предположил, что момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде
|
Здесь me – масса электрона, υ – его скорость, rn – радиус стационарной круговой орбиты. Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением
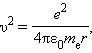
|
где e – элементарный заряд, ε 0 – электрическая постоянная. Скорость электрона υ и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
|
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен
|
Радиусы последующих орбит возрастают пропорционально n2. Целое число n = 1, 2, 3,... называется в квантовой физике атома главным квантовым числом.
Успехи теории Бора в объяснении спектральных закономерностей в изучении атома водорода были поразительны. Стало ясно, что атомы – это квантовые системы, а энергетические уровни стационарных состояний атомов дискретны. Почти одновременно с созданием теории Бора было получено прямое экспериментальное доказательство существования стационарных состояний атома и квантования энергии. Дискретность энергетических состояний атома была продемонстрирована в 1913 г., в опыте Д. Франка и Г. Герца, в котором исследовалось столкновение электронов с атомами ртути.
Лабораторная работа - «не предусмотрено».
Практические занятия:
1. Строение атома: планетарная модель и модель Бора.
2. Квантовые постулаты Бора. Решение тестовых заданий.
Тест: «Строение атома».
Вариант 1.
1. Что представляет собой альфа-частица?
А. электрон. Б. Полностью ионизованный атом гелия. В. один из видов электромагнитного излучения.
2. Какой заряд имеет ядро, согласно планетарной модели атома Резерфорда?
А. положительный Б. отрицательный В. ядро заряда не имеет.
3. Определите, сколько электронов имеет атом бериллия 94Ве.
А. 9 Б. 4 В. 5 Г. 13
4. Определите с помощью таблицы Менделеева, атом какого химического элемента имеет массу приблизительно 16 а.е.м.
А. кислород Б. сера В. фтор
5. В каком из приборов для регистрации частиц прохождение быстрой заряженной частицы вызывает появление следа из капелек жидкости?
А. счетчик Гейгера Б. камера Вильсона В. пузырьковая камера
6. Кто открыл явление радиоактивности?
А. М. Кюри; Б. Дж. Томсон; В. Н. Бор; Г. Э. Резерфорд; Д. А. Беккерель.
7. Изменяется ли атом в результате радиоактивного распада?
А. атом не изменяется; Б. изменяется запас энергии атома, но атом остается атомом того же химического элемента; В. атом изменяется, превращается в атом другого химического элемента; Г. атом на короткое время изменяется, но очень быстро возвращается в прежнее исходное состояние; Д. в результате радиоактивного распада атом полностью исчезает.
8. Кто предложил ядерную модель строения атома?
А. Беккерель; Б. Томсон; В. Резерфорд.
9. Чему равно массовое число ядра атома марганца 5525Мn?
А. 25 Б. 80 В. 30 Г. 55.
 10. На рисунке изображены схемы четырех атомов. Черные точки – электроны. Какая схема соответствует атому 42Не?
10. На рисунке изображены схемы четырех атомов. Черные точки – электроны. Какая схема соответствует атому 42Не?
Вариант 2.
1. Что представляет собой бета-частица?
А. электрон. Б. Полностью ионизованный атом гелия. В. один из видов электромагнитного излучения.
2. Какой заряд имеет атом, согласно планетарной модели атома Резерфорда?
А. атом электрически нейтрален; Б. отрицательный; В. положительный
3. Определите, сколько электронов имеет атом железа 5626Fе.
А. 56 Б. 30 В. 26 Г. 82
4. Определите с помощью таблицы Менделеева, атом какого химического элемента имеет массу приблизительно 65 а.е.м.
А. медь Б. цинк В. тербий
5. Какой прибор при прохождении через него ионизирующей частицы выдает сигнал в виде кратковременного импульса электрического тока?
А. счетчик Гейгера Б. камера Вильсона В. пузырьковая камера
6. По какому действию было открыто явление радиоактивности?
А. по действию на фотопластинку; Б. по ионизирующему действию на воздух; В. по вспышкам света, вызываемым в кристаллах ударами частиц; Г. по следам в камере Вильсона.
7. Для регистрации каких частиц в основном используется счетчик Гейгера?
А. альфа-частиц; Б. бета-частиц; В. протонов.
8. С помощью опытов Резерфорд установил, что …
А. положительный заряд распределен равномерно по всему объему атома; Б. положительный заряд сосредоточен в центре атома и занимает очень малый объем; В. в состав атома входят электроны; Г. атом не имеет внутренней структуры.
9. Чему равен заряд ядра атома стронция 8838Sr?
А. 88 Б. 38 В. 50 Г. 126.
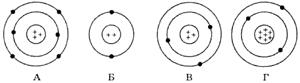 10. На рисунке изображены схемы четырех атомов. Черные точки – электроны. Какая схема соответствует атому 73Li?
10. На рисунке изображены схемы четырех атомов. Черные точки – электроны. Какая схема соответствует атому 73Li?
Вопросы для самоконтроля по теме:
- В чём отличие модели атома Томпсона от планетарной модели?
- Расскажите постулаты Бора?
- В чём суть квантования энергии?
|
|