
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
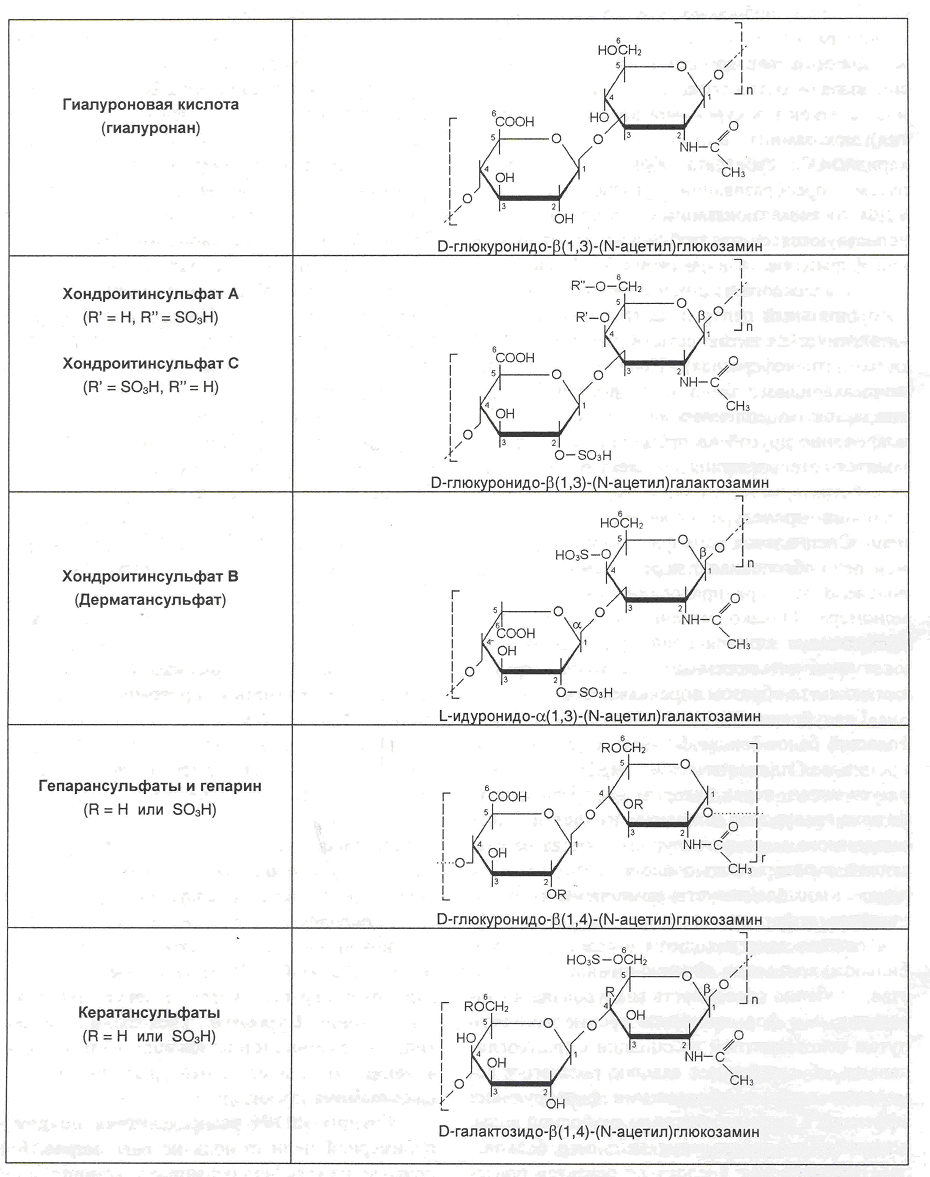
Структурные звенья различных гликозаминогликанов
|
|
[И.Г. Щербак, 2005]
Основные функции ГАГ:
-структурные компоненты основного вещества межклеточного матрикса, с которым взаимодействуют коллаген, эластин и другие белки внеклеточного пространства;
- входят в состав суставных хрящей и играют рессорную роль;
- играют роль молекулярного сита в межклеточном матриксе, препятствуют распространению патогенных микроорганизмов и опухолевых клеток;
- присоединяя большие количества катионов (Na+, К+, Са2+) и воды, участвуют в формировании тургора различных тканей;
- кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
- гепарин является естественным антикоагулянтом;
- гепарансульфаты во взаимодействии с белками способствуют созданию фильтрационного барьера в почках, могут участвовать в клеточной адгезии и межклеточных взаимодействиях.
Гиалуроновая кислота (гиалуронан) состоит из дисахаридных звеньев: D-глюкуроновая кислота - b(1®3)-N-ацетилглюкозамин. В большинстве тканей, кроме хряща, встечаются и в свободном виде, и в составе протеогликанов. Особенно преобладает она в рыхлой волокнистой соединительной ткани, в стекловидном теле глаза, пупочном канатике, хрящах, суставной жидкости. Молекулярная масса достигает 105-107Да. Синтезируется в отличии от всех других белков на внутренней поверхности плазматической мембраны, а не на рибосомах или эндоплазматической ретикулуме. Гиалуронан-синтетаза пронизывает плазматическую мембрану с образованием канала, через который выводятся вновь синтезируемая молекула гиалуроновой кислоты в межклеточное пространство.
Хондроитин сульфаты имеют молекулярную массу от 10000 до 50000 Да. В качестве структурной единицы содержат D-глюкуроновую кислоту - b(1®3)-N-ацетилгалактозамин, который содержит сульфатную группу. В зависимости от ее положения различают хондроитин-4-сульфатилихондроитинсульфат А и хондроитин-6-сульфатилихондроитинсульфат С. Очень близок к ним по строению дерматансульфат, который состоит из мнокократно повторяющегося дисахарида: L-идуроновая кислота - b(1®3)-N-ацетилгалактозамин-4-сульфат. Дерматансульфат иногда называют хондроитинсульфат В.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Хондроитинсульфатами богата хрящевая ткань, они входят в состав кожи, костной ткани, сухожилий, клапанов сердца, пуповины межпозвонковых дисков и других тканей.
Гепарансульфат и гепарин сходны с глюкуроновой кислотой по строению дисахаридных единиц, но наиболее сульфатированные ГАГ: содержат остаток серной кислоты во 2-ом положении уроновой кислоты в 3-м и 6-м положениях в N-ацетилглюкозамине. Они имеют разные структурные варианты: отличаются неравномерным расположением сульфогрупп по длине полимера, заменой и чередованием глюкуроновой и идуроновой кислот, N-ацетилгалактозамина с N-сульфатгалактозамином. Как правило, гепарансульфат обнаруживается на поверхности многих клеток. Гепарин отличается меньшими размерами (5000-20000 Да). Локализован гепарин в гранулах тучных клеток. Поступая при их дегрануляции в межклеточную среду, гепарин препятствует свертыванию крови, активируя (выступая как кофактор) антиплазмин III. Гепарин также активирует липопротеинлипазу, расщепляющую триглицериды плазмы в составе хиломикронов и липопротеинов очень низкой плотности.
Кератансульфаты отличаются по распределению в тканях и суммарному содержанию углеводов. Основной дисахарид в их структуре содержит D-галактозу и N-ацетилглюкозамин-6-сульфат. Сульфатированию может подвергаться и галактоза в 6-ом положении. Кроме того, в составе кератансульфатов встречаются N-ацетигалактозамин, L-фукоза, D-манноза и сиаловая кислота. Цепи кератансульфата небольшие (5000-15000 Да) и в зависимости от способа взаимодействия их с белком различают: кератансульфат I (N-гликозидная связь с аспарагином) и кератансульфат II (О-гликозидная связь с радикалом серина или треонина). Содержатся кератансульфаты в роговище глаза – кератансульфат I, в хрящевой ткани, межпозвонковых дисках – кератансульфат II.
Протеогликаны. В тканях основная масса ГАГ находится в соединении с белками. Лишь гиалуроновая кислота существует не только в связанном с белками состоянии, но и в свободном. Протеогликаны – высокомолекулярные соединения, которые состоят из белка (5-10%) и гликозаминогликанов (90-95%). Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы, и они получили название – коровый белок. Протеогликаны составляют основную массу межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, в формированиии поддержании формы клеток и органов, образовании каркаса при формировании тканей.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
К настоящему времени установлена структура более 30 протеогликанов. Их подразделяют на 4 семейства:
-гиалектаны;
- малые протеогликаны, богатые лейцином;
- протеогликаны базальных мембран;
- протеогликаны, встроенные в мембрану клеток.
Гиалектаны. Эти белки с большой молекулярной массой, имеющие особые участки нековалентно связанные с гиалуроновой кислотой, а также домены, сходные с лектинами или белками, избирательно сорбирующими определенную углеводную структуру, например, содержащую L-фукозу, N-ацетилглюкозамин, D-галактозу. Наиболее широко они представлены в хрящевой ткани, стенке аорты, сухожилиях, мозге, хотя встречаются во многих тканях. Из гиалектинов более подробно изучены агрекан и версикан.
Агрекан – самый крупный из протеогликанов, с молекулярной массой до 2, 5·106Да. Полипептидная цепь имеет 4 зоны высокого сродства с гиалуроновой кислотой, лектиноподобные домены сорбции фукозы или N-ацетилглюкозамина, иммуноглобулиновый домен области контакта с белками комплемента. Коровый белок через остатки серина, кроме того, ковалентно связан с 100-150 цепями хондроитинсульфата и 30-60 более короткими цепочками кератансульфатов (рис. 19 и 20).
| Сер | Коровый белок | |||
| ½ | ||||
| СН2 | ||||
| ½ | ||||
| О | ||||
| ½ | ||||
| Ксилоза | ü ½ ý Связующая область ½ þ | |||
| ½ | ||||
| Галактоза | ||||
| ½ | ||||
| Галактоза | ||||
| ½ | ||||
| Глюуроновая кислота | ü Повторяющаяся ý дисахаридная þ единица | |||
| ½ | ||||
| Аминосахар | ||||
Рисунок 19. Схема ковалентной связи корового белка с гликозаминогликановыми цепями через связующую область.
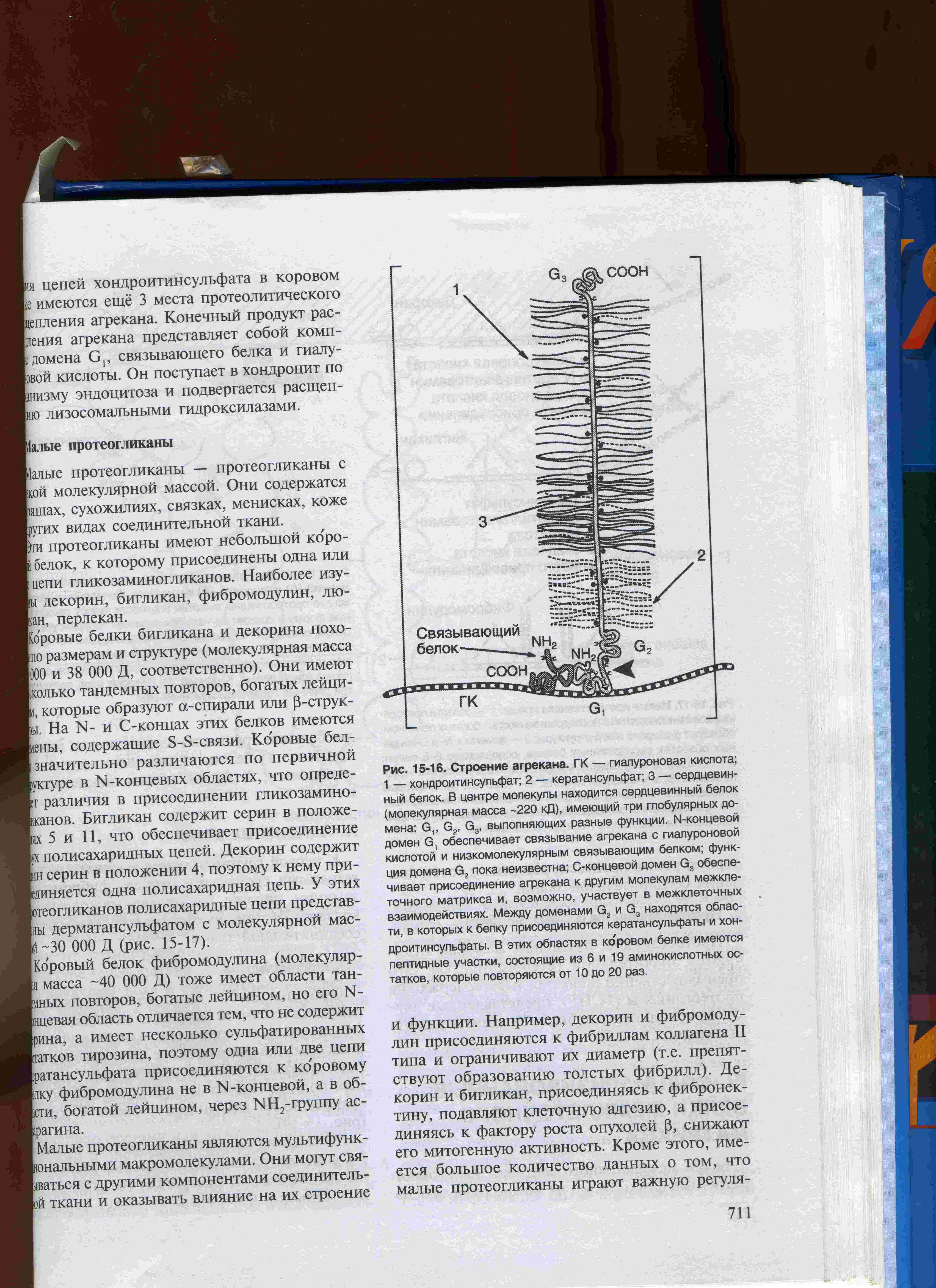
Рисунок 20. Схема строения агрекана [Е.С. Северин, 2003].
ГК – гиалуроновая кислота, 1 – хондроитинсульфат, 2 – кератансульфат,
3 – коровый (сердцевинный) белок, G1, G2, G3 –глобулярные домены.
Версикан – также мультидоменный белок с молекулярной массой около 106 Да. Очень похож на агрекан наличием иммуноглобулинового и гиалуронан-связывающих участков, лектиноподобным, комплементсвязывающим и другими доменами. Однако, имеет более крупный коровый белок и связывается с малым количеством (всего 10-20) дерматан- и хондроитинсульфатных цепей. Не связан с кератансульфатами, но содержит участки (до 20) связывания N-олигосахаридов. К гиалектанам относят также нейракан и бревикан, обнаруживаемые в основном в мозге, - более меньшие по величине молекулы.
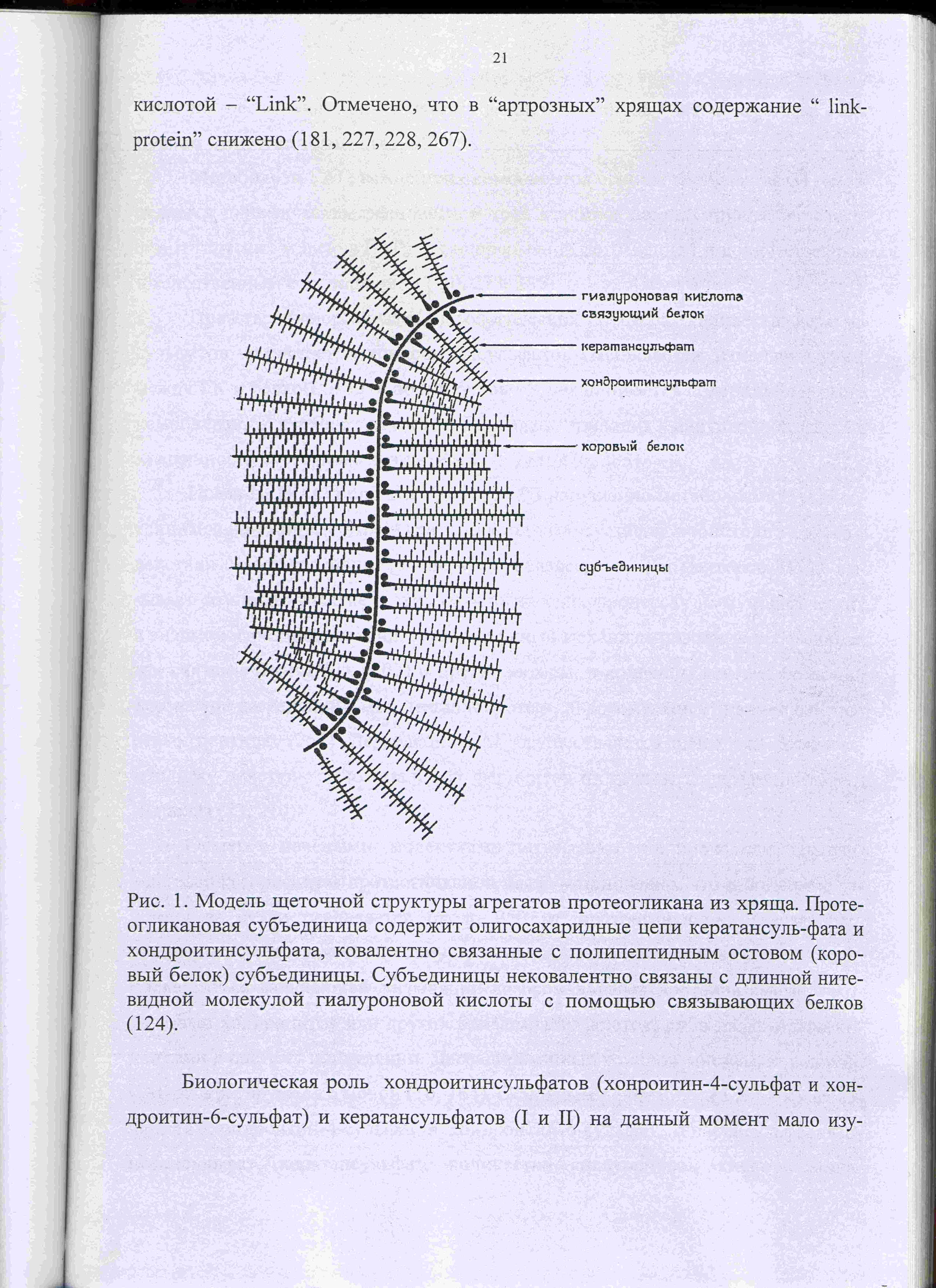
Рисунок 21. Модель щеточной структуры надмолекулярных агрегатов гиалуронана и гиалектанов из хряща.
Гликозаминогликановые цепи в гиалектанах присоединены к стержню корового белка перпендикулярно. Обилие полисахаридных цепей позволяет им поддерживать высокий уровень гидратации. На N-конце белковой цепи гиалектаны имеют 2-4 связующих домена, обладающих очень высоким сродством к гиалуроновой кислоте. Будучи мультидоменными белками гиалектаны формируют во внеклеточном пространстве более крупные агрегаты – надмолекулярные структуры. При этом с огромной молекулой гиалуронана (длина его может достигать 15 мкм) с помощью N-концевых связующих доменов взаимодействуют до 100 гиалектанов. Возникает структура, напоминающая по внешнему виду ершик для мытья посуды (рис. 21), особенно характерная для ткани хряща. Масса таких агрегатов достигает сотен миллионов дальтон, они хорошо гидратируют и генерируют осмотическое набухание внеклеточного матрикса.

Рисунок 22. Схема строения малых протеогликанов, богатых лейцином [Е.С. Северин, 2003].
1 – область повторяющихся аминокислотных последовательностей, богатых лейцином, 2 – домены N- и С-концевые коровых белков, содержащие дисульфидные связи, 3 –цепи дерматансульфата, соединенные с гидроксильной группой серина корового белка, 4 – короткие цепи ГАГ, присоединенные в области повторов, богатых лейцином, © - остатки олигосахаридов, связанные с белками по NН2-группе аспарагина (N-гликозидные связи).
Малые протеогликаны, богатые лейцином (рис. 22) обладают небольшим коровым белком, имеющим многократные «лейциновые» повторы. Их молекулярная масса составляет до 40000 Да, однако они легко связываются со многими другими белками и клеточными мембранами, в частности, с коллагенами типа I, II, III, V, VI.Но они не формируют комплексы с гиалуроновой кислотой. Содержат радикалы тирозинсульфата. К группе этих белков относятся бигликан, декорин, фибромодулин, люмикан, кератокан, эпификан. Бигликан содержит 2 N-связанной олигосахаридной цепи (хондроитин- или дерматансульфата). Его особенно много в суставном хряще. Декорин включает одну цепь хондроитин- или дерматансульфата. Преобладает в костях, коже, сухожилиях, стенке аорты, склере и роговице глаза. Связывается с коллагенами I и II типов, с фибронектином, тромбоцитарным фактором роста – бета. Эпификан участвует в упорядочивание структуры эпифизарного хряща и, вероятно, в формировании костной ткани. Обнаружен в связках, плаценте. Содержит в молекуле 3 дерматансульфатных цепи и единичные N-олигосахариды. Фибромодулин обладает высоким сродством к коллагенам I и II типов и регулирует скорость образования коллагеновых фибрилл. Протеогликан включает 2-4 остатка кератансульфата. Присутствует в хрящах, коже, сухожилиях и других тканях. Люмикан по своим свойствам напоминает фибромодулин, но имеет меньшее число тирозинсульфатов. Кератокан – близок по структуре люмикану, но содержит лишь 6 лейциновых повторов. В сочетании с тромбоцитарным фактором роста - бета индуцирует образование кости.
Протеогликаны базальных мембран отличаются по размерам (от 140000 до 470000 Да), как правило, содержат лишь 3-4 олигосахаридные цепи (в основном гепарансульфаты). Самым крупным белком данного семейства является перликан. Полипептидная цепь его изобилует дисульфидными мостиками внутри молекулы, разнообразием функционально-структурных доменов в пределах одной молекулы, позволяющим связываться с различными белками (коллаген IV типа, ламинин, нидоген, ингибитор сериновых протеаз и др.) и клетками, представляя им места прикрепления к подложке. К семейству этих белков относятся также агрин, бамакан. Молекулы агрина почти вдвое меньше перлакана. Больше всего агрина содержится в базальной мембране почечных канальцев и в постсинаптической мембране нейронов, где он формирует кластеры рецепторов ацетилхолина и сирегаты молекул ацетилхолинэстеразы. Бамакан локализован в различных базальных мембранах. В отличие от перлекана и агрина содержит цепи не кератансульфатов, а хондроитинсульфата, имеет участки связывания с клетками и ламинином.
Протеогликаны, встроенные в мембрану клеток, содержат в своем составе цепи гепарансульфатов. К ним относятся синдеканы и глипиканы. Синдеканы – группа трансмембранных белков (молекулярная масса 22000-43000 Да) с большим внеклеточным доменом, содержащим значительное количество пролина и имеющим 5-8 гепарансульфатных цепей. Внутриклеточные домены синдеканов короткие, связаны с цитоскелетом клетки. Некоторые синдеканы специализированы по типам клеток: эпителиальные, мезенхимные, нейронные, надкостничные и др. Глипиканы – белки, богатые цистеином, имеют компактную форму, молекулярную массу от 57000 до 87000 Да, содержат 2-6 гепариновых цепей. Содержатся в нейронах, почках, мышцах. На мембране клеток эти протеогликаны удерживаются благодаря ковалентной связи их белкового кора с гликозилированным фосфатидилинозитолом, жирно-кислотные радикалы которого погружены в бислойную мембрану, своеобразный «якорь». Выступающий тетрасахаридный фрагмент «якоря» соединяет инозитол с фосфатидилэтаноламином, образующим пептидную связь с концевой карбоксильной группой корового белка.
Мультидоменный тип строения является наиболее характерной чертой многих макромолекул основного вещества внеклеточного матрикса. Это позволяет разнообразить межбелковые и клеточно-белковые взаимодействия. Свой вклад в данный процесс вносят и углеводные фрагменты. Благодаря этому протеогликаны, особенно протеогликаны, встроенные в мембраны (базальные – перлекан, агрин, бамакан и клеточные – глипиканы, синдеканы), способны участвовать в трансмембранной передаче внешних сигналов рецепторного характера, а не только обеспечивают теснейшее взаимодействие клеток с окружающим матриксом.
| Глюкоза | |||||||||||||||||||
| АТФ | ||||||||||||||||||
| АДФ | |||||||||||||||||||
| Глюкоза–6-Ф | |||||||||||||||||||

| 
| ||||||||||||||||||
| Глюкоза 1-Ф | Фруктоза-6-Ф | ||||||||||||||||||
УТФ

| 
| 
| Глутамин Глу | ||||||||||||||||
| Глюкозамин-6-Ф | |||||||||||||||||||

| Ацетил-КоА | ||||||||||||||||||
| КоASH | |||||||||||||||||||
| УДФ-глюкоза | 
| УДФ-галактоза | |||||||||||||||||
| N-ацетилглюкозамин-6-Ф | ||||||||||||||||||

| |||||||||||||||||||
| УДФ-глюкуроновая кислота | N-ацетилглюкозамин-1-Ф | ||||||||||||||||||

| 
| 
| 
| УТФ | |||||||||||||||

| |||||||||||||||||||
| УДФ-идуроновая кислота | УДФ-ксилоза | ФАФС | УДФ-N-ацетил-глюкозамин | УДФ-N-ацетил-галактозамин | |||||||||||||||
| |||||||||||||||||||
| 
| 
| 
| ||||||||||||||||
| Гликозаминогликаны | Гликозамиминопротеогликаны | ||||||||||||||||||
| Гликопротеины | |||||||||||||||||||
Рисунок 23. Биосинтез сахаридов – предшественников ГАГ, протеогликанов, гликопротеинов.
Биогенез протеогликанов осуществляется по единой стратегии. Построение каждого из углеводных фрагментов на молекуле корового белка начинается еще в растущей полипептидной цепи или сразу после завершения ее синтеза. Первый моносахарид присоединяется О-гликозидной связью в определенном месте белка, а затем происходит наращивание углеводной цепочки с участием соответствующей гликозилтрансферазы, используя чаще всего активированную форму углеводного компонента – уридиндифосфат-сахара (УДФ-сахар) (рис. 23). Лишь иногда используются производные других нуклеотидов – цитидинмонофосфат-N-ацетилнейраминовая кислота, гуанозиндифосфат-манноза (ГДФ-манноза). Таких гликозилтрансфераз известно более 200, которые сосредоточены в мембране эндоплазматического ретикулума. Субстратная специфичность этих гликозилтрансфераз, а также очередность их действия предопределяют структуру строящейся цепи ГАГ.
Сульфатированные ГАГ, кроме кератансульфатов, присоединяются к коровому белку через специфическую структуру, включающую тетрасахарид из последовательно соединенных остатков ксилозы-галактозы-галактозы-глюкуронида. Ксилоза взаимодействует гидроксилсодержащей аминокислотой (сер, тре) и далее на тетрасахаридной структуре идет наращивание полисахаридной цепи ГАГ.
Биогенез полисахаридов, соединенных с белком N-гликозидной связью, происходит не на белковой молекуле сразу, а на специальном «носителе» - долихолфосфате, имеющем цепь из многократно повторяющихся изопреноидных единиц с фосфорилированной гидроксильной группой на одном конце. На «носителе» синтезируется пентасахаридная структура, которая лишь потом переносится на коровый белок. Долихолфосфат встроен в мембрану эндоплазматического ретикулума так, что остаток фосфорной кислоты располагается на внешней (цитоплазматической) стороне мембраны. После присоединения к фосфатной группе первого звена пентасахаридной структуры «носитель» разворачивается внутрь, и углеводный компонент оказывается обращенным в просвет эндоплазматичесеого ретикулума, где достраиваются остальные 4 фрагмента. После этого специальный олигосахарид-трансфераза освобождает долихолфосфат, перенося пентасахарид на коровый белок, где происходит взаимодействие с амидной группой аспарагина. Далее развивается процесс удлинения олигосахаридной структуры и ее построение по нужной структуре.
Процесс сульфатирования, внедрения сульфатных групп, начинается сразу после завершения полисахаридных цепей. Источником сульфогрупп является 3¢ -фосфоаденозин-5¢ -фосфосулфат (ФАФС)-эктивная форма сульфата. ФАФС образуется с участием бифункционального фермента ФАФС-синтетазы (рис. 24), обладающего АТФ-сульфурилазной и аденилилсульфат-киназной активностью.
Перенос сульфогрупп с ФАФС на углеводные остатки ГАГ осуществляют О-сульфотрансферазы, имеющие субстратную специфичность.
Катаболизм углеводных фрагментов протеогликанов и ГАГ матрикса в основном протекает в лизосомах с участием гликозидаз и протеиназ. В рузультате образуются углеводные молекулы и аминокислоты, которые либо распадаются до конечных продуктов обмена, либо повторно используются для биосинтетических цепей. Из внеклеточного матрикса гликозаминогликаны и протеогликаны поступают в клетку по механизму эндоцитоза, заключаются в эндоцитозные пузырьки, которые сливаются с лизосомами. Ферменты,
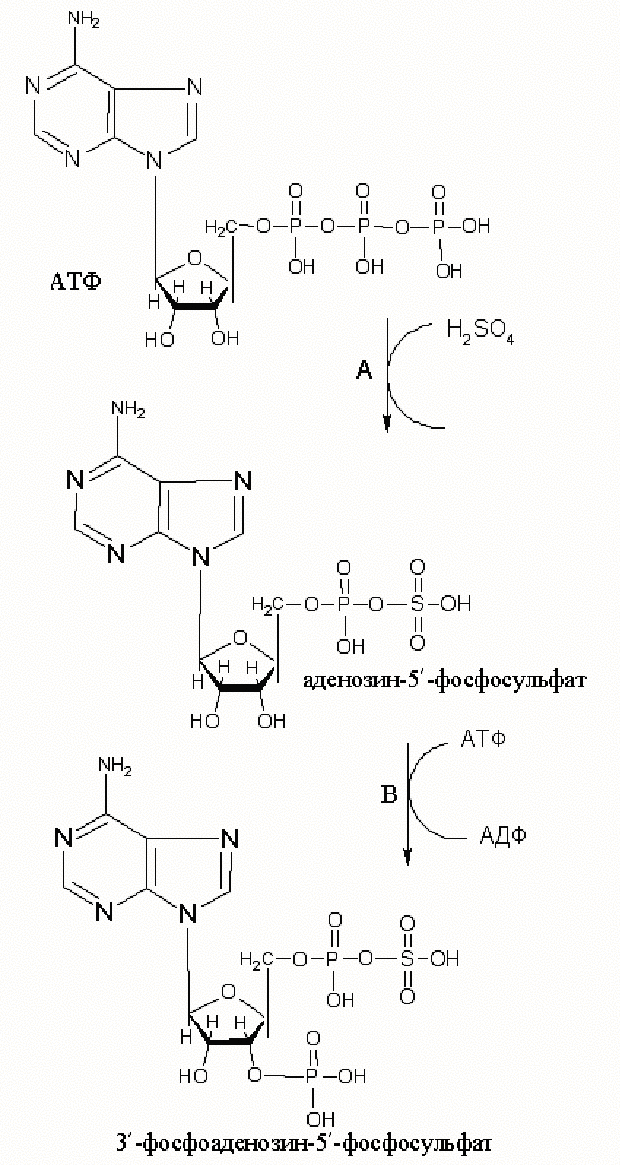
Рисунок 24. Схема синтеза ФАФС, катализируемого АТФ-сульфурилазной (А) и аденилилсульфат-киназной (В) активностями ФАФС-синтетазы.
участвующие в расщеплении полисахаридных цепей и другие (b-глюкозаминидаза, b-галактозидаза, нейраминидаза, b-галактозаминидаза, L-фукозидаза, N-гликиназа, b-ксилозидаза, a-галактозидаза, сульфатазы, идуронидаза и др.) обладают абсолютной специфичностью, но действуют чрезвычайно согласованно. Отщепление углеводных компонентов обнажает коровый белок и делает его доступным действию лизосомальных катепсинов и пептидаз.
Отсутствие какого-либо фермента может приводить к возникновению наследственных дефектов метаболизма, получивших название мукополисахаридозы. Эти заболевания характеризуются избыточным накоплением ГАГ в тканях, приводящим к деформации скелета, увеличением органов, изменением структуры и функции хрящесодержащих и других тканей (поражение сосудов, дефекты клапанов сердца, помутнение роговицы, деформации формы ушей, носа и т.д.), сопровождаются нарушениями умственного развития ребенка и уменьшением продолжительности жизни. Известно несколько типов мукополисахаридозов. Например, при болезни Гюнтера «выпадает» идуронитсульфатаза и накапливается дерматансульфат, при Слая - b-глюкуро-нидаза и накапливается в тканях хондроитинсульфаты.
Специализированные белки межклеточного матрикса. Они представлены в основном гликопротеинами, не входящими в состав коллагеновых и эластиновых волокон межклеточного матрикса. Основная функция этих белков сводится к организации взаимодействия компонентов межклеточного матрикса между собой и с клетками. Среди них можно выделить белки, обладающие адгезивными свойствами и белки, подавляющие адгезию клеток.
Адгезивные белки. Выраженными адгезивными свойствами обладают фибронектин, ламинин, нидоген, а также фибриллярные коллагены и коллаген типа IV.
Фибронектин – крупный белок с молекулярной массой около 550000 Да, является одним из клеточных белков экстрацеллюлярного матрикса. Состоит из двух субъединиц одинаковых или несколько различающихся, которые соединены двумя дисульфидными мостиками. Каждая субъединица имеет модульное строение. Каждый модуль – это типовая последовательность нескольких десятков аминокислотных остатков. Молекула содержит 3 типа модулей: фибронектин типа I (ФН-I), ФН-II, ФН-III. Модуль ФН-I состоит из 30-45 аминокислотных остатков, модуль ФН-II – из 60-65, а модуль ФН-III – из 90 аминокислотных остатков. Молекула субъединицы фибронектина представляет собой тандемное повторение 12 доменов ФН-I, прерываемое двумя модулями ФН-II, далее блоком из 16 модулей ФН-III, за которым следуют 3 модуля типа I (рис. 25). Почти по всей молекуле субъединицы белка распределены 7 участков гликозилирования. Различают растворимую (плазменную) и нерастворимую (тканевую) формы фибронектина, которые практически гомологичны. Растворимый фибронектин синтезируется гепатоцитами, нерастворимый – фибробластами, эпителиальными и др. клетками. Фибронектин вовлекается в многочисленные биохимические реакции: способствует адгезии и распространению эпителиальных и мезенхимальных клеток, стимулирует пролиферацию и миграцию эмбриональных клеток. В этой связи фибронектину принадлежит особая роль в процессах регенерации. Столь важная роль фибронектина связана с наличием разнообразных центров узнавания других макромолекул. Модули ФН-I содержат остатки цистеина, образующие дисульфидные связи и формирующие изгибы полипептидной цепи в виде петли – «фибронектиновые пальцы». На их выступающих участках расположены участки, обладающие высоким сродством к некоторым структурам: гепарансульфатам, тромбосподину, нидогену, фактору некроза опухоли – альфа и др. Далее имеются центры связывания для коллагенов I типа и типа IV. Блок доменов ФН-III имеет центры сцепления с клетками. Это участок, содержащий последовательность Арг-Гли-Асп, избирательно ассоциирует с интегрином (важнейшее семейство клеточных рецепторов). N-концевая часть фибронектина также имеет сродство к специальным рецепторам на поверхности клеток, получившим название «место сборки матрикса». Имеются доказательства того, что эти рецепторы опосредуют процесс организации растворимых димеров фибронектина в нерастворимые (тканевые) мультидимерные структуры фибриллярного типа, которые, в свою очередь, вносят существенный вклад в создание надмолекулярной организации внеклеточного пространства.

Рисунок 25. Схема модульного строения субъединицы фибронектина [И.Г. Щербак, 2005].
(Модули ФН-I обозначены прямоугольниками, ФН-II квадратами, ФН-III- овалами).
Ламинин является главным адгезивным гликопротеином базальных мембран. Он не только играет роль адгезивного субстрата для различных эпителиальных и мезенхимальных клеток, но и усиливает пролиферацию и подвижность скелетных миобластов, опухолевых клеток, индуцирует поляризацию и дифференцировку эндотелиальных и других клеток. Это большая молекула, состоящая из трех различных субъединиц размерами от 180000 до 340000 Да: А-, В1- и В2-цепи. Они объединены –S-S-связями и образуют крестообразную структуру, короткие отростки которой, содержащие В1- и В2-цепи, состоят из двух глобулярных доменов вытянутыми цепями (рис. 26). Субъединицы ламинина могут существовать в разных вариантах, однако все варианты содержат значительное количество (до 40) олигосахаридных структур и радикалов цистеина, которые образуют более 40 внутренних дисульфидных связей. Ламинин содержит также участки, напоминающие эпидермальный фактор роста (ЭФР-домены), последовательности аминокислот (Арг-Гли-Асп), обеспечивающие связывание клеток, а также домены, отвечающие за взаимодействие с гепарансульфатами, адгезивными молекулами межклеточного взсимодействия (интегринами) и другими компонентами основного вещества.
Нидоген (эктактин) (молекулярная масса 148000 Да) – гликопротеин, сосредоточенный на базальных мембранах. Тесно ассоциирован с ламинином, имеет несколько ЭФР-доменов, центр клеточной адгезии и множество внутренних дисульфидных мостиков (рисунок 26). Кроме того, нидоген содержит два остатка сульфатированного тирозина, два участка связывания Са2+, зоны связывания с коллагеном типа IV, с клеточной поверхностью (Арг-Гли-Асп) и др. Это свидетельствует о том, что нидоген обеспечивает специализированные контакты между клетками и межклеточными структурами.

Рисунок 26. Схема структупной организации комплекса ламинин-нидоген (нидоген прикоепляется к фрагменту молекулы ламинина, содержащей и центры взаимодействия с клетками).
Антиадгезивные молекулы представлены такими гликопротеинами, как остеонектин, тенасцин и тромбоспондин. Они играют заметную роль в эмбриогенезе, морфогенезе, развитии клеточного ответа на повреждение. Остеонектин (ВМ-40, SPARS) – был впервые экстрагирован из матрикса опухолевой ткани и базальной мембраны вместе с ламинино-нидогеновым комплексом. Кислый белок, богатый цистеином, имеет 2 домена, способных присоединять Са2+. Участвует в клеточно-матриксном взаимодействии в процессе ремоделирования и развития ответа клеток на различные повреждения.
Тенасцин – димерный гликопротеин с молекулярной массой более 100000 Да. Имеет мозаичную структуру, включающую ЭФР-домены, центры адгезии клеток, Са-связывающие и другие. Две субъединицы белка соединены дисульфидной связью и в целом имеют 6 отростков (похож на осьминога), отходящих радиально от одного участка. Тенасцин, благодаря такому строению, может взаимодействовать со значительным количеством различных молекул межклеточного матрикса. Белок синтезируется в различных тканях эмбриона, обладает адгезивными и антиадгезивными свойствами. В зрелых тканях небольшие количества теносцина находятся в сухожилих и хрящах. Его синтез увеличивается в заживающих ранах.
Тромбоспондин содержит глобулярные С- и N-концевые домены, которые связываются с Са2+, протеогликанами и ГАГ (гепарансульфаты, гепарин), коллагеном, фибронектином, ламинином, интегринами, фибриногеном, плазминогеном и другими белками. Для кератиноцитов, тромбоцитов, в клетках роговицы глаза тромбоспондин является адгезивным белком, а для клеток эндотелия, фибробластов – антиадгезивным.
Структурная организация межклеточного матрикса. Матриксные гликопротеины, протеогликаны и коллагены обладают способностью к самоагрегации и образуют регулярные структуры, формирующие супрамолекулярный комплекс, представленный сложной сетью связанных между собой макромолекул (рис. 27). Эти супрамолекулярные структуры окружают клетки, обеспечивают их адгезию, участвуют в клеточной миграции, в регуляции клеточного роста и дифференцировке. Протеогликаны связываются с фибронектином, ламинином, коллагенами и другими компонентами экстарцеллюлярного матрикса, а также с поверхностными компонентами клеток и служат основными рецепторами при сборке внеклеточного матрикса. При этом участвуют и в регуляции клеточной адгезии, а также способны связывать цитокины и факторы роста и таким образом опосредованно регулировать клеточный рост.
В организме человека межклеточный матрикс формирует такие специализированные ткани, как базальные мембраны, сухожилия, хрящ, кости, зубы, которые существенно отличаются между собой как по молекулярному составу, так и по характеру, способам организации основных компонентов.
Внеклеточный матрикс – не инертная среда для клеток, а динамичная система, которая, взаимодействуя со структурными клетками и частично с клетками–мигрантами, непрерывно обновляется и способна к перестройке мор фологических структур, ремоделированию, при изменении функциональных

Рисунок 27. Схема организации внеклеточного матрикса. [М.А. Пальцев, А.А. Иванов, 1995]. КIV – коллаген типа IV, Л - ламинин, Н – нидоген, Фн – фибронектин, ГС – гепарансульфат.
нагрузок или иных сдвигов. Резидентные клетки способны улавливать даже незначительные изменения в комбинации, концентрации и распределении компонентов матрикса, динамично реагировать на них и на этой основе динамично поддерживать гомеостаз. Интенсивность метаболизма гиалуроновой кислоты в коже высока, период полужизни ее (Т1/2) составляет примерно сутки, а в суставном хряще – до трех недель. При повреждении и в экстремальных условиях интенсивность обмена компонентов внеклеточного матрикса может резко возрастать.
|
|
