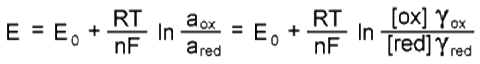Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Равновесный электродный потенциал. Уравнение Нернста. Водородная шкала потенциалов.
|
|
Принципы измерения электрической проводимости растворов электролитов с помощью мостика Кольрауша.
Измерение электрической проводимости растворов электролитов производят при помощи моста Кольрауша, питаемого переменным током высокой частоты (2-10 —3-10 Гц) от звукового генератора. Установка для измерения сопротивления раствора электролита состоит из барабанного реохорда с известным сопротивлением (курбельные магазины сопротивления от 0, 1 до 10 Ом), сосуда для измерения электрической проводимости (рис. 120), нуль-инструмента (низкоомный телефон, индикатор нуля, осциллограф). Компенсационная схема моста Кольрауша основана на применении закона Кирхгофа, согласно которому в точке А ток разветвляется и идет по проводникам АСВ и АОВ. Обозначив силу тока в проводнике АВВ через /, а в проводнике ЛСВ —через 2 и выразив падение напряжения на участке цепи через произведение силы тока на соответствующее сопротивление.

Кондуктометрическое титрование. Графики кондуктометрического титрования сильной кислоты сильным основанием и слабой кислоты сильным основанием.
Существование линейной зависимости между концентрацией разбавленных растворов электролитов и их электрической проводимостью делает возможным использование кондуктометрии при титровании анализируемого раствора для определения точки эквивалентности.
Кондуктометрическим титрованием называется титриметрический метод анализа, в котором точка эквивалентности определяется по изменению электрической проводимости раствора в ходе титрования.
Кондуктометрическое титрование состоит в том, что к точному объему исследуемого раствора, помещенного в электрохимическую ячейку, добавляют из бюретки равными порциями титрант и после каждого добавления измеряют электрическое сопротивление в ячейке.
При титровании могут протекать различные химические реакции: нейтрализации, осаждения, комплексообразования, окислительно-восстановительные. Общим требованием к ним является достаточно резкое различие в электропроводящих свойствах веществ, присутствующих в системе до и после точки эквивалентности. Наиболее часто это условие выполняется в реакциях нейтрализации.
Зависимость между электрической проводимостью титруемого раствора и добавленным объемом титранта отражается в виде кондуктометрической кривой титрования - графика зависимости 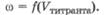 Кондуктометрическая кривая титрования исследуемого раствора одного соединения состоит из двух ветвей, пересекающихся в точке эквивалентности. Характер кривых титрования зависит от силы электролитов, присутствующих в системе, и подвижности их ионов. Рассмотрим несколько примеров.
Кондуктометрическая кривая титрования исследуемого раствора одного соединения состоит из двух ветвей, пересекающихся в точке эквивалентности. Характер кривых титрования зависит от силы электролитов, присутствующих в системе, и подвижности их ионов. Рассмотрим несколько примеров.
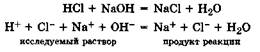
1. Титрование сильной кислоты сильным основанием, например раствора НСl раствором NaOH. При титровании протекает реакция:
Как видно из уравнения, до точки эквивалентности идет эквивалентное замещение ионов Н+ на менее подвижные катионы Na+(u°(H+) > u°(Na+)), в результате чего электрическая проводимость раствора уменьшается
( (NaCl) <
(NaCl) <  (HCl)). За точкой эквивалентности электрическая проводимость возрастает (рис. 24.3), что связано, во-первых, с увеличением количества ионов за счет из бытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
(HCl)). За точкой эквивалентности электрическая проводимость возрастает (рис. 24.3), что связано, во-первых, с увеличением количества ионов за счет из бытка титранта (NaOH), во-вторых, с участием в переносе заряда высокоподвижных ионов ОН-. Абсцисса точки на кривой титрования, отвечающая резкому изменению электрической проводимости, соответствует эквивалентному объему щелочи (Vэкв), идущему на титрование раствора анализируемой кислоты.
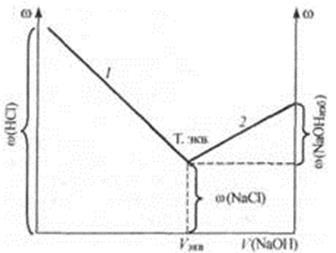
Рис 24.3. Кривая кондуктометрического титрования сильной кислоты сильным основанием.
|
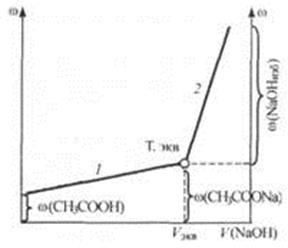
Рис 24.4. Кривая кондуктометрического титрования слабой кислоты сильным основанием.
2. Титрование слабой кислоты (СН3СООН) раствором сильного основания (NaOH). При титровании протекает реакция:
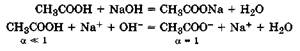
В данном случае до точки эквивалентности электрическая проводимость возрастает (рис. 24.4), так как по мере титрования молекулы слабодиссоциирующей кислоты замещаются эквивалентным количеством соли - сильного электролита ( (СН3СООNа) > >
(СН3СООNа) > >  (СН3СООН)).
(СН3СООН)).
За точкой эквивалентности проводимость продолжает возрастать, но более резко, что объясняется появлением избытка сильного основания NaOH.
Равновесный электродный потенциал. Уравнение Нернста. Водородная шкала потенциалов.
Равновесный электродный потенциал – это потенциал электрода, описываемый уравнением Нернста, т. е. потенциал электрода в растворе, когда окислительная и восстановительная реакции уравновешены.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Потенциометрические методы основаны на измерении электродвижущих сил (ЭДС):
E=E1-E2
где E - электродвижущая сила (ЭДС);
E1 и E2 - потенциалы электродов исследуемой цепи.
Потенциал электрода E связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
где E0 - стандартный потенциал редокс-системы; R - универсальная газовая постоянная, равная 8, 312 Дж/(моль К); T - абсолютная температура, К; F - постоянная Фарадея, равная 96485 Кл/моль; n - число электронов, принимающих участие в электродной реакции; aox, ared - активности соответственно окисленной и восстановленной форм редокс-системы; [ox], [red] - их молярные концентрации; Гox, Гred - коэффициенты активности. E=E0 при aox = ared = 1, причем имеется в виду гипотетический стандартный 1 М раствор, в котором коэффициент активности каждого растворенного вещества равен 1, а чистые вещества находятся в наиболее устойчивом физическом состоянии при данной температуре и нормальном атмосферном давлении. Подставляя T=298, 15 и числовые значения констант в уравнение, получаем для 25 °C
|
|
|