
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химия как наука
|
|
Современная химия и ее место в системе естественных наук. Химия как наука о веществах и их превращениях. Предмет химии. Основные понятия и законы химии.
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений.
Химические явления: одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется.
Физические явления: меняется физическое состояние веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или образуются новые вещества с изменением состава ядер атомов.
Химия как наука
Химия как самостоятельная дисциплина определилась в XVI—XVII веках, после ряда научных открытий, обосновавших механистическую картину мира. М. В. Ломоносов уже в первой известной своей работе, именно к данной области естествознания отношение имеющей — «Элементы математической химии» (1741), в отличие от большинства химиков своего времени, считавших эту сферу деятельности искусством, классифицирует её как науку, начиная труд свой словами [4]
1.Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2.Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства.
3.Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 117 элементов
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
| Массовое число Заряд ядра | A Z | Э | 63 29 | Cu и | 65 29 | Cu; | 35 17 | Cl и | 37 17 | Cl |
Химическая формула - это условная запись состава вещества с помощью химических знаков и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода.
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Количество вещества, моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро ди Кваренья (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6, 02 · 1023. (Постоянная Авогадро имеет размерность - моль-1).
Молярная масса показывает массу 1 моля вещества (обозначается M).
M = m / n
Закон сохранения массы веществ (М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
2. Оксиды: классификация, составление формул, номенклатура, химические свойства, способы получения.
ОКСИДЫ.
Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
| Формула | Название | Формула | Название |
| CO | оксид углерода (II) | Fe2O3 | оксид железа (III) |
| NO | оксид азота (II) | CrO3 | оксид хрома (VI) |
| N2O5 | оксид азота (V) | Mn2O7 | оксид марганца (VII) |
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 
|
| нагреванием оснований | Cu (OH)2=CuO+H2O | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 
| |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 
| |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.
| Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами МgO+2HCl=MgCl2+H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 | Амфотерные (ZnO, Al2O3, Cr2O3, MnO2) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 | Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
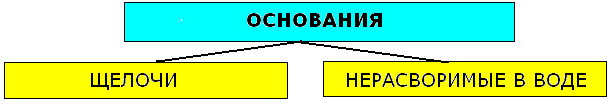
3. Основания: классификация, составление формул, номенклатура, химические свойства, способы получения.
Основания -сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
Физические свойства: твердые кристаллические вещества. В воде растворимы щелочи: LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, другие-малорастворимы.
| Формула | Название | Формула | Название |
| LiOH | гидроксид лития | Ca(OH)2 | гидроксид кальция |
| NaOH | гидроксид натрия | Cu(OH)2 | гидроксид меди(II) |
| KOH | гидроксид калия | Fe(OH)2 | гидроксид железа(III) |
ПОЛУЧЕНИЕ.
| Щелочи | 1.Металл+вода | 2Na+2H2O=2NaOH+H2  Ba+2H2O=Ba(OH)2+H2 Ba+2H2O=Ba(OH)2+H2 
|
| 2.Оксид+вода | Li2O+H2O=2LiOH CaO+H2O=Ca(OH)2 | |
| 3.Электролиз растворов щелочных металлов | 2NaCl+2H2O=2NaOH+Cl2+H2 
| |
| Нерастворимые основания | Соль+щелочь | CuSO4+2NaOH=Cu(OH)2+Na2SO4 |
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ.
| |
| 1.Взаимодействие с кислотами | |
| KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами | |
| 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов | |
| лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами | |
| 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |
| NaOH+CuCl2=Cu(OH)2+2NaCl | не реагируют |
| 6.При нагревании | |
| не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Амфотерные гидроксиды(Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие. | |
| Взаимодействуют с кислотами Zn(OH)2+2HCl=ZnCl2+2H2O | Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4] |
4. Кислоты: классификация, составление формул, номенклатура, химические свойства, способы получения.
Кислоты -сложные вещества, состоящие из одного или нескольких атомов водорода, способных заместиться на атом металла, и кислотного остатка.Число атомов кислорода определяет основность кислот.
ПОЛУЧЕНИЕ.
| Кислородсодержащие | 1.Кислотный оксид+вода | SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 |
| 2.Металл+сильный окислитель | P+5HNO3+2H2O=3H3PO4+5NO | |
| 3.Cоль+менее летучая кислота | NaNO3+H2SO4=HNO3  +NaHSO4 +NaHSO4
| |
| Бескислородные | 1.Водород+неметалл | H2+Cl2=2HCl |
| 2.Cоль+менее летучая кислота | NaCl+H2SO4=2HCl  +NaHSO4 +NaHSO4
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ

| |
| 1.Изменяют окраску индикаторов | |
| лакмус-красный, метилоранж-красный (только для растворимых кислот) | |
| 2.Взаимодействие с металлами, стоящими до водорода | |
H2SO4+Ca=CaSO4+H2 
| 2HCl+Ca=CaCl2+H2 
|
| 2.Взаимодействие с основными оксидами | |
| H2SO4+CaO=CaSO4+H2O | 2HCl+CaO=CaCl2+H2O |
| 3.Взаимодействие с основаниями | |
| H2SO4+Ca(OH)2=CaSO4+2H2O | 2HCl+Ca(OH)2=CaCl2+2H2O |
| 4.Взаимодействие с амфотерными оксидами | |
| H2SO4+ZnO=ZnSO4+H2O | 2HCl+ZnO=ZnCl2+H2O |
| 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
| H2SO4+BaCl2=BaSO4+2HCl | 2HCl+Na2CO3=2NaCl+H2O+CO2 
|
| 6.При нагревании | |
| Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 | H2S=H2+S |
| Физические свойства кислот | ||
| Жидкости H2SO4 HClO4 и др. | Твердые H3PO4 H2SiO3 и др. | Газообразные HCl H2S и др. |
5. Соли: классификация, составление формул, номенклатура, химические свойства, способы получения.
Соли -сложные вещества, состоящие из атома металла, или иона аммония NH+4 и кислотного остатка (иногда содержат водород).
| КЛАССИФИКАЦИЯ СОЛЕЙ | |

|
НАЗВАНИЯ НЕКОТОРЫХ СОЛЕЙ.
| Кислотный остаток (анион) | Название соли |
| Cl- | хлорид |
| F- | фторид |
| NO3- | нитрат |
| NO2- | нитрит |
| S2- | сульфид |
| SO32- | сульфит |
| SO42- | сульфат |
| CO32- | карбонат |
| SiO32- | силикат |
| PO43- | фосфат |
| CN- | цианид |
| NCS- | тиоционат |
| ClO- | гипохлорит |
| ClO2- | хлорит |
| ClO3- | хлорат |
| ClO4- | перхлорат |
ПОЛУЧЕНИЕ.
| 1.С использованием металлов | металл+неметалл | Mg+Cl2=MgCl2 |
| металл+кислота | Zn+2HCl=ZnCI2+H2 
| |
| металл+соль | Fe+CuSO4=FeSO4+Cu | |
| 2.С использованием оксидов | основной оксид+кислота | CaO+2HCl=CaCl2+H2O |
| кислотный оксид+основание | CO2+Ca(OH)2=CaCO3+H2O | |
| кислотный+основной оксиды | CaO+CO2=CaCO3 | |
| основной+амфотерный оксиды | Al2O3+CaO=Ca(AlO2)2 | |
| 3.Реакция нейтрализации | кислота+основание | H2SO4+2NaOH=Na2SO4+2H2O |
| 4.Из солей | соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3
|
| соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4
| |
| соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
| |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты) | ||
| NaOH+H2SO4=NaHSO4+H2O | ||
| Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи) | ||
ZnCl2+NaOH=ZnOHCl  +NaCl +NaCl
|
ХИМИЧЕСКИЕ СВОЙСТВА солей
| Разложение при прокаливании | CaCO3=CaO+CO2 
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
|
ГИДРОЛИЗ СОЛЕЙ.
| Гидролиз солей- взаимодейтсвие солей с водой, приводящее к присоединению протона Н+ молекулы воды к аниону кислотного остатка или гидроксогруппы ОН- к катиону металла. Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям, или анионами, соответствующими слабым кислотам. |
| Соль образована слабым основанием и сильной кислотой | Соль образована сильным основанием и слабой кислотойкислотой |
CuCl2=Cu2++2Cl- H2O  H++OH- Cu2++H2O H++OH- Cu2++H2O  CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O  CuOHCl+HCl CuOHCl+HCl
|
Na2CO3=2Na++CO32- H2O  H++OH- CO32-+H2O H++OH- CO32-+H2O  HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O  NaHCO3+NaOH NaHCO3+NaOH
|
| Соль образована слабой кислотой и слабым основанием | |
(NH4)S=2NH4++S2- NH4++H2O  NH3· H2O+H+ S2-+H2O NH3· H2O+H+ S2-+H2O  HS-+OH- Образуется слабодиссоциированный анион HS- и растворенный в воде аммиак. HS-+OH- Образуется слабодиссоциированный анион HS- и растворенный в воде аммиак.
| Al2S3+6H2O=2Al(OH)3  +3H2S +3H2S  Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S
|
| Гидролиз усиливается |
| а) при нагревании раствора (гидролиз обычно эндотермический процесс) б) при разбавлении раствора водой |
|
|