
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Прямые биосенсоры на основе пероксидазы хрена
|
|
Биосенсоры с иммобилизованной пероксидазой хрена могут быть использованы в первую очередь для определения субстрата пероксидазы — пероксида водорода. Эта задача весьма актуальна: существует потребность в анализах биологических жидкостей и других растворов для определения пероксида водорода вследствие его ключевой роли в различных процессах, протекающих в человеческом организме и в окружающей среде.
Есть примеры использования нативной пероксидазы хрена в прямых безмедиаторных биосенсорах. Показана возможность развития процесса прямого электронного переноса на поверхности электродов из графита [14], золота и платины [15] с иммобилизованным слоем пероксидазы хрена. Описаны биосенсоры с пероксидазой хрена, иммобилизованной на графитовых электродах, для определения фенола и его производных [16]. Феноксильные радикалы, образующиеся при ферментативном окислении производных фенола в присутствии пероксида водорода, могут быть восстановлены электрохимически; ток восстановления пропорционален их концентрации в растворе. Потенциал, при котором происходит электрохимическое восстановление феноксильных радикалов, зависит от электронодонорных свойств заместителя в молекуле производного фенола. Высокая чувствительность метода была достигнута при определении 2-амино-4-хлорофенола (85 нA/см2·мкМ) и 4-хлор-3-метилфенола (14 нA/см2·мкМ).
Пероксидазу хрена использовали в амперометрических биосенсорах для определения общего уровня биогенных аминов, которые являются нейромедиаторами. Предел обнаружения серотонина составил 17 нг/мл, время отклика сенсора 0, 5 с, при этом не требовалась предварительная обработка образцов [17].
Существенным недостатком нативной пероксидазы в качестве биораспознающего элемента является то обстоятельство, что регистрируемая скорость прямого переноса электрона на поверхности сенсорного электрода оказывается, как правило, довольно низкой и составляет менее 2 с–1. Это можно объяснить несколькими причинами. Во-первых, активный центр нативной пероксидазы расположен достаточно глубоко в гидрофобном кармане ее глобулы и расстояние для переноса электрона слишком велико. Во-вторых, гликозилированные остатки на поверхности нативной пероксидазы могут действовать как изолятор и затруднять электронный перенос между активным центром этого фермента и электродом. По этим причинам применение нативной пероксидазы хрена не всегда позволяет получить безмедиаторную сесорную систему с хорошим откликом.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В связи с развитием методов генной инженерии появилась возможность получать рекомбинантные формы белков, структура которых позволяет сократить расстояние между активным центром биомолекулы и поверхностью электрода. В работе [18] изучалась электрохимическая активность различных форм пероксидазы хрена — нативной и рекомбинантной. Использовалась рекомбинантная пероксидаза, полученная методом генной инженерии, которая в отличие от нативной пероксидазы не содержит углеводных остатков и поэтому имеет меньший размер по сравнению с нативным ферментом. Кроме того, была получена рекомбинантная форма пероксидазы, в молекулу которой на С-конец при экспрессии были введены шесть гистидиновых остатков. Известно, что гистидины сравнительно легко адсорбируются на золоте. В нейтральной среде гистидин взаимодействует с поверхностью золотого электрода по хемосорбционному механизму [19] возможно посредством атома азота имидазольного кольца. При значениях рН в кислотной области адсорбция осуществляется через атомы кислорода карбоксильной группы гистидина. Адсорбция гистидина на золоте носит электростатический характер. Электроокисление самого гистидина протекает только при очень больших концентрациях и высоких потенциалах, поэтому не мешает проведению анализа. В работе [20] исследовано влияние длины полигистидинового фрагмента на адсорбцию фермента на поверхности золота. Лучшие результаты были получены при введении шести гистидиновых остатков на С-конец молекулы фермента. Дальнейшее увеличение количества гистидиновых остатков затрудняет экспрессию и восстановление фермента.
Для рекомбинантных форм пероксидазы зафиксирован процесс прямого переноса электронов [18], скорость которого больше чем на порядок по сравнению с нативным ферментом, что позволяет сконструировать очень чувствительный биосенсор для определения пероксида водорода. С использованием вращательного дискового электрода была оценена константа гетерогенного переноса электрона для молекул пероксидазы, иммобилизованных на поверхности этого электрода [21]. Если для нативной пероксидазы значение константы равно 1, 2 с–1, то в случае рекомбинантной пероксидазы константа переноса электрона на один порядок больше и составляет 18 с–1, а для мутантных форм она увеличивается до 32 с–1. Биосенсор для определения пероксида водорода, сконструированный на основе рекомбинантной пероксидазы с шестью гистидиновыми остатками на конце молекулы, обладает очень высокой чувствительностью, предел обнаружения пероксида водорода 10 нM [22]. На рис. 2 приведены градуировочные графики определения пероксида водорода.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
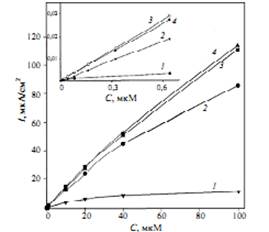
Рис. 2. Зависимость предельного кинетического тока электрохимического биосенсора от концентрации H2O2.
На поверхности золотого электрода иммобилизованы нативная пероксидаза (1), рекомбинантная пероксидаза (2), рекомбинантная пероксидаза с шестью гистидиновыми остатками на N (3) и С (4) концах.
Изучение влияния рН и доноров протона на константу скорости гетерогенного переноса электронов показало существенное повышение эффективности электронного переноса с увеличением концентрации H+ [23].
|
|
